

- 资源


全球采购和临床试验外包部门专业人员面临着与日俱增的压力,需实施人工智能 (AI) 解决方案,以实现变革性成本节约、运营效率提升及临床试验成本监管强化。众所周知,临床研究试验费用高昂,新药上市前的平均研发成本从 1.61 亿至 45.4 亿美元不等,具体取决于治疗领域。2019 年,临床生命科学领域的语言服务市场规模约为 10.1 亿美元。2023 年,全球语言服务及技术市场的总体潜在规模预计达 26.8 亿美元。
候选药物一旦成功通过第一阶段人体试验,临床开发便会转向跨国模式,因此需要广泛的语言服务与本地化支持来推进全球临床开发计划。然而,尽管 AI 已在革新临床试验领域的以下方面,试验申办者对于将其用于临床试验和研究语言成果仍普遍持谨慎避险态度:
- 设计
- 执行
- 分析
Lionbridge 坚信,欧盟 (EU) 对临床试验申请的改革是生命科学领域应用 AI 的典型案例,特别是在支持语言成果和与生命科学翻译服务提供商建立战略采购合作伙伴关系方面。
EU 范围内的集中化资料提交:新的机遇
通过实施临床试验信息系统 (CTIS),EU 允许临床试验申办者和医疗器械制造商就其在欧盟开展的跨国研究提交一份整合的临床试验申请资料。EU 相关法规(临床试验法规 [CTR]、医疗器械法规 [MDR] 和体外诊断医疗器械法规 [IVDR])及 CTIS 平台共同助力欧盟各成员国实现联合授权流程。
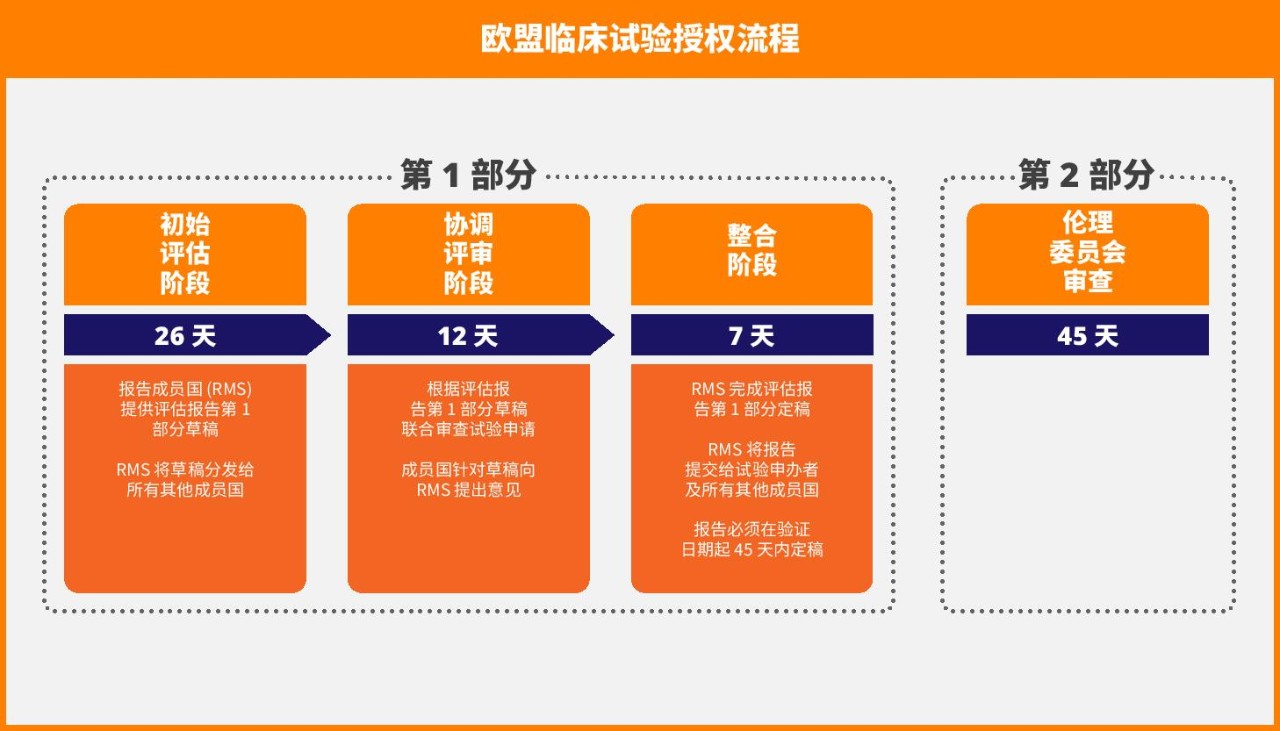
临床试验授权流程已精简为 45 天的程序,由一个成员国担任报告成员国 (RMS),负责协调所有相关成员国的评估事宜。这比此前 60 天的流程缩短了 15 天。整个过程包括以下连续步骤:
- 评估阶段,为期 26 天
- 协调评审阶段,为期 12 天
- 整合阶段,为期 7 天
与此同时,在同样的 45 天评估期内,每个成员国的伦理委员会都会审查申请资料的第 2 部分。
协调评审和整合阶段的语言成果可能需要快速修订,或者监管机构可能要求提供当地语言版本的附加信息。试验团队需及时响应监管机构的信息请求,并高效统筹各个国家/地区语言相关事务,以避免延误或申请自动失效。
集中管理语言服务:临床试验领域 AI 应用的战略必要性
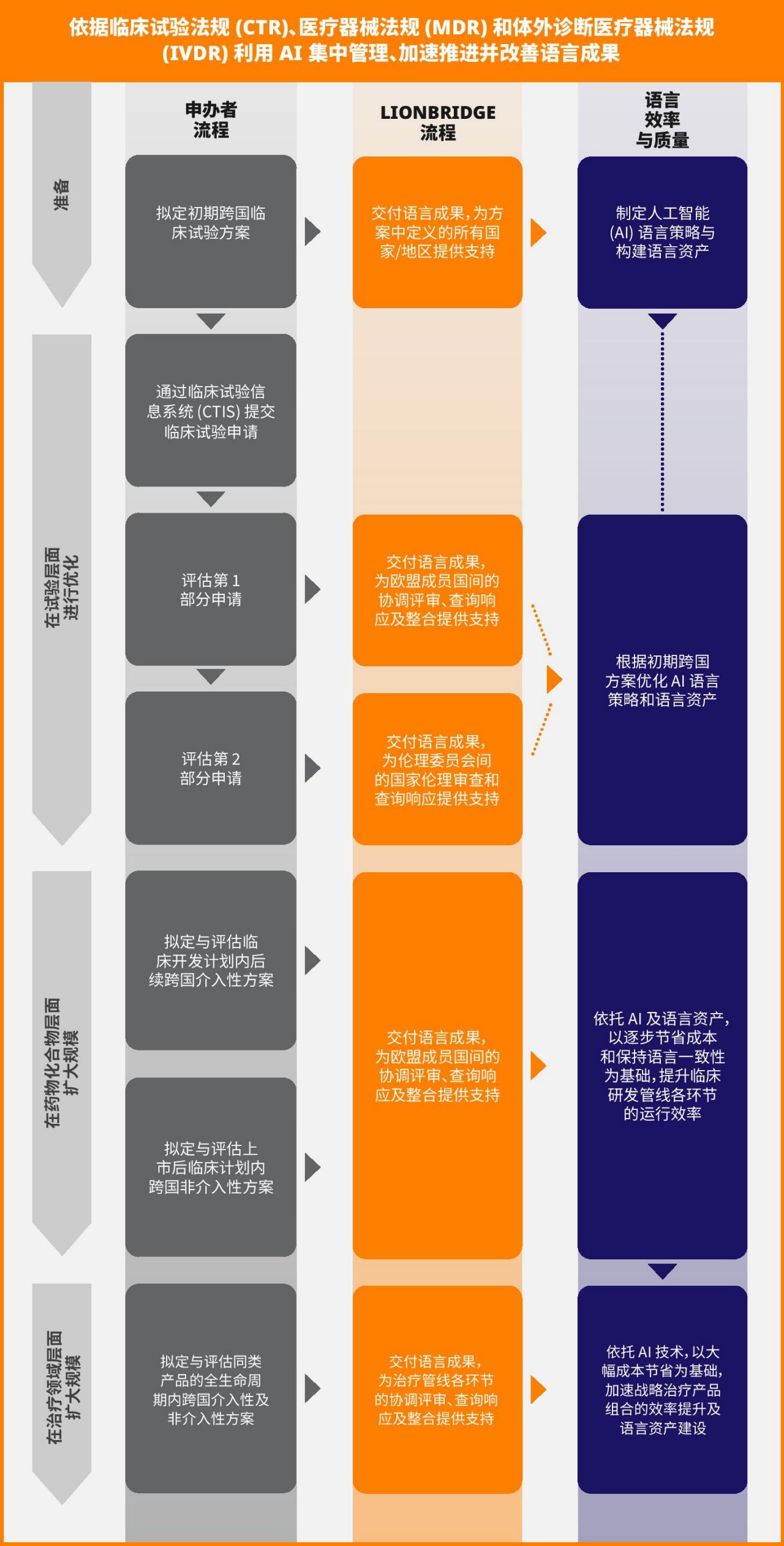
EU 修订后的法规中严格的时间表和默示决策原则会鼓励申办者集中管理临床试验翻译服务。通过分散的本地试验管理职能来管理语言结果,与监管机构协调和简化临床试验授权程序的努力相矛盾。由于多项关键研究在多个 EU 国家/地区开展,去中心化可能会成为实现临床试验关键 III 期里程碑的一大风险因素。此外,坚持多供应商采购策略,试验申办方可能会错失使用单个 AI 系统及 AI 翻译带来的显著成本节约机会,包括:
- 集中实行翻译规模化
- 总结
- 内容创作
多供应商采购策略通常由质量管理体系 (QMS) 决定,以确保降低业务风险并获得有竞争力的价格。然而,在同一临床开发项目中从不同语言服务供应商获取语言成果并非明智之举,且相较集中化方法风险更高。遵循多供应商 QMS 程序通常会导致不一致并增加临床试验预算的负担。对于严格审查研发成本的行业来说,这尤其麻烦。
试验申办者可以将 AI 用于临床试验,以逐步实现成本节约,同时提高语言质量和一致性。这一目标可在以下任何层面实现:
- 试验
- 化合物
- 治疗
集中管理药械组合研究的语言成果
AI 支持的语言成果不仅在产品层面展现出巨大潜力。临床试验越来越多地将药品研究与体外诊断设备的性能研究或医疗器械的临床研究结合起来。
虽然 CTR、MDR 及 IVDR 下临床试验授权流程缺乏一致性,但集中管理语言成果仍能显著提升组合研究效率。Lionbridge 建议在组合研究中,将 AI 融入针对各种类型内容的临床试验语言策略。这种方法使得体外诊断医疗器械与药物组合研究能够共享术语、语言资产和内容,从而为个性化药物开发提供强有力支持。在药物及其伴随诊断的开发过程中,可以预先确定 AI 工作流程并与词汇表一起实施,从而帮助:
- 提高效率
- 变更程序
- 协调信息传递与性能声明以支持共同目标
像对待 CRO 一样对待您的语言服务提供商
随着临床研究成本的不断上升,委托研究机构 (CRO) 对于成功和高效地执行临床试验至关重要。随着时间的推移,其角色已从承担试验管理职责的服务提供商演变为能对以下方面发挥作用的真正合作伙伴:
- 试验设计
- 数据管理
- 患者招募
数字化试验执行和临床试验 AI 也为 B2B 关系中的战略合作开辟了新的途径。
随着大型语言模型 (LLM) 革新整个内容之旅,申办者如今可与语言服务提供商 (LSP) 建立类似的战略合作伙伴关系,并充分利用 AI 推动临床试验领域发展。
联系我们
准备好探索语言和内容解决方案来支持您的整个药品和医疗器械开发生命周期了吗?Lionbridge 融合 LLM、卓越语言、法规及生命科学内容领域的多学科专长,形成独特竞争力。我们提供先进且定制的 AI 解决方案,覆盖规划、创建、分析、总结和本地化,全程为您提供支持。敬请联系我们。







