Services Supplémentaires


Étude de cas
Nouvelles solutions de création de contenu par l'IA pour un géant des accessoires et vêtements de sport

- RESSOURCES
Pôles de connaissances Lionbridge
- Surmontez les limitations des LLM
- Résultats positifs pour les patients


SÉLECTIONNER LA LANGUE :
Les professionnels de l’approvisionnement mondial et de l’externalisation clinique sont confrontés à une pression croissante pour la mise en œuvre de solutions d’IA capables de générer des économies de coûts impactantes, des gains d’efficacité opérationnelle et une meilleure surveillance des coûts des essais cliniques. Il est bien connu que les essais de recherche clinique entraînent des coûts importants. Les coûts moyens de R&D avant le lancement d'un nouveau médicament varient de 161 millions à 4,54 milliards de dollars, selon le domaine thérapeutique. Le marché total des services linguistiques dans le domaine des sciences de la vie cliniques était estimé à 1,01 milliard de dollars en 2019. Le marché mondial total adressable des services et technologies linguistiques en 2023 était estimé à 2,68 milliards de dollars.
Une fois qu'un médicament candidat passe avec succès les essais cliniques de phase 1 sur l'homme, le développement clinique devient multinational. Il nécessite alors des services linguistiques et de localisation étendus pour faciliter les plans de développement clinique à l'échelle internationale. Mais les sponsors sont souvent réticents face à l'idée de prendre des risques avec l'IA pour les essais cliniques et les résultats linguistiques de la recherche. Pourtant, l'IA révolutionne déjà les essais :
- Conception
- Conduite
- Analyse
Chez Lionbridge, nous sommes convaincus que les réformes de l'UE concernant les demandes d'essais cliniques constituent un argument de poids en faveur de l'IA dans les sciences de la vie, notamment pour les résultats linguistiques et pour les partenariats d'approvisionnement stratégiques avec les services de traduction en sciences de la vie.
Dossiers de soumission centralisés dans toute l'UE : une nouvelle opportunité
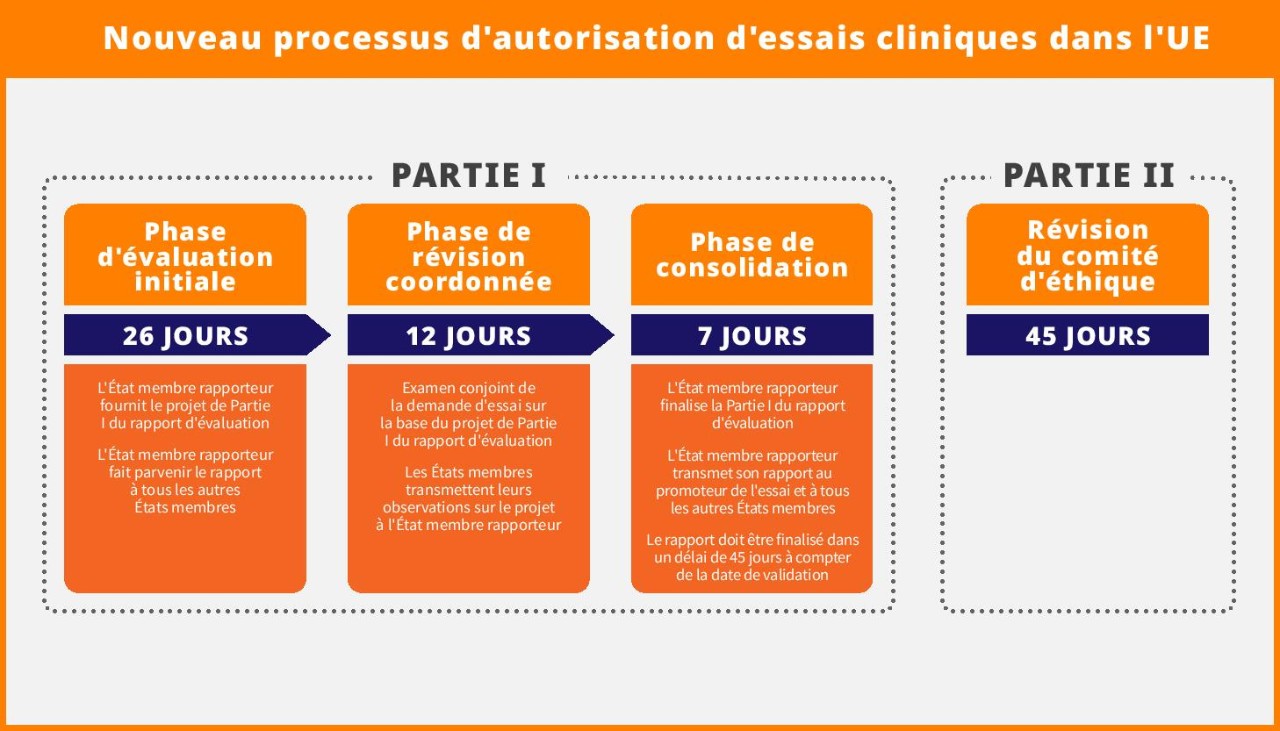
La mise en œuvre du Système d'information sur les essais cliniques (CTIS) dans l'UE permet aux promoteurs d'essais cliniques et aux fabricants de dispositifs médicaux de soumettre un dossier unique de demande d'essais cliniques pour les études multinationales menées dans l'UE. Les règlements de l'UE (CTR, RDM et RDMDIV) et la plateforme CTIS permettent la mise en place d'un processus d'autorisation conjoint dans tous les États membres de l'UE.
Le processus d’autorisation des essais cliniques est rationalisé en une procédure de 45 jours, un État membre agissant en tant qu’État membre rapporteur (EMR) et responsable de l’évaluation coordonnée dans tous les États membres concernés. Ce processus réduit la procédure de 15 jours par rapport au processus précédent de 60 jours. Il comprend les étapes séquentielles suivantes :
- Phase d'évaluation de 26 jours
- Phase d'examen coordonné de 12 jours
- Phase de consolidation de 7 jours
Parallèlement, au cours de la même période d’évaluation de 45 jours, les comités d’éthique de chaque État membre passent en revue la partie 2 du dossier de demande.
Les résultats linguistiques obtenus au cours des phases d’examen coordonné et de consolidation peuvent nécessiter une révision rapide, ou les organismes de réglementation peuvent demander des informations supplémentaires dans les langues locales. L'équipe en charge des essais doit répondre rapidement aux demandes d'informations réglementaires et gérer rapidement les activités linguistiques dans tous les pays afin d'éviter les retards ou l'expiration automatique de la demande.
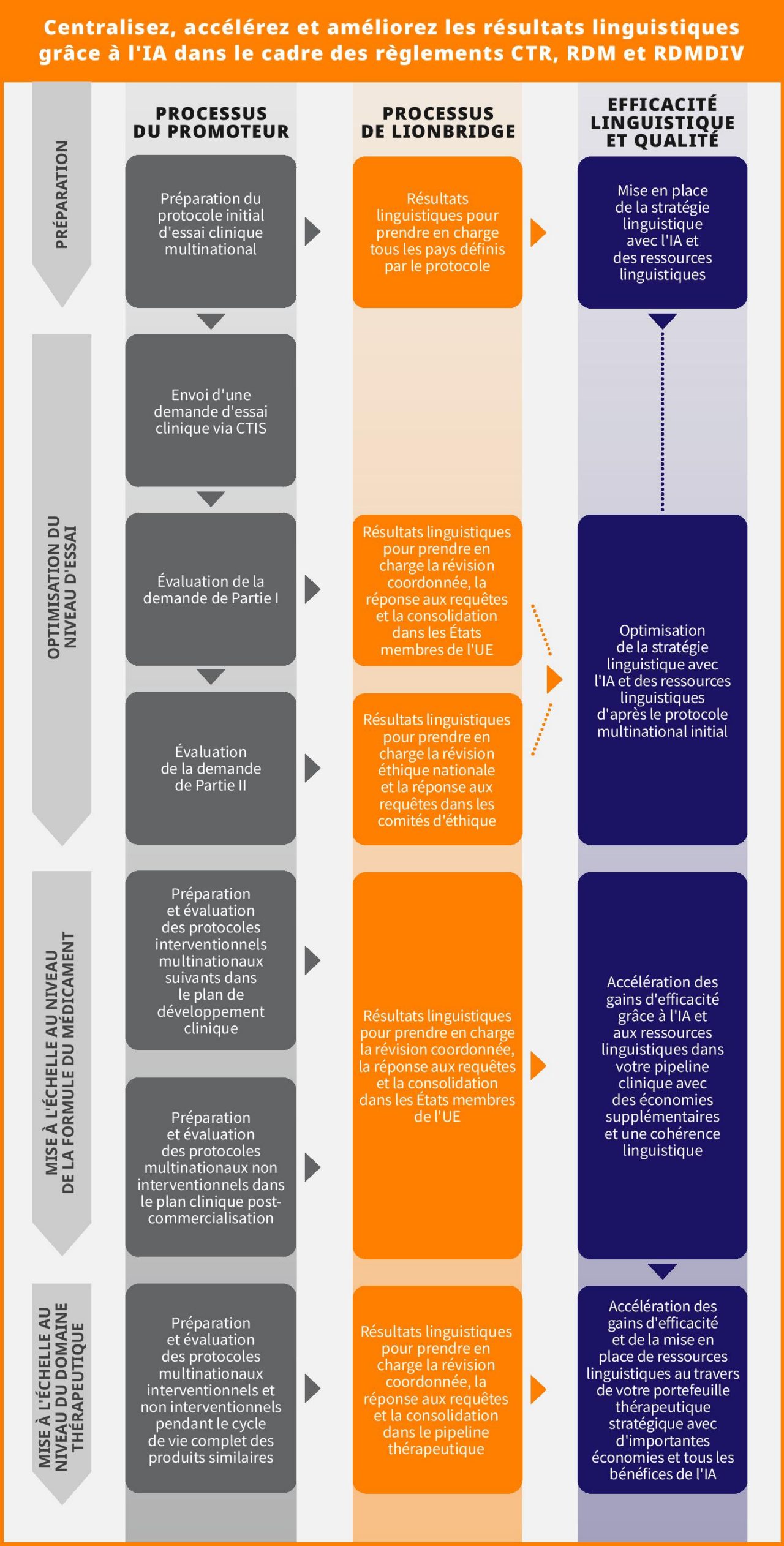
Centralisation des services linguistiques : un impératif stratégique pour l'IA dans les essais cliniques
Les délais stricts et les principes de décision tacite des règlements révisés de l’UE devraient encourager les promoteurs à centraliser les services de traduction des essais cliniques. La gestion des résultats linguistiques par le biais de fonctions décentralisées de gestion des essais locaux contredit les efforts des régulateurs visant à harmoniser et à rationaliser les procédures d’autorisation des essais cliniques. De nombreuses études pivots sont réalisées dans plusieurs pays de l’UE. C'est pourquoi la décentralisation peut devenir un facteur de risque dans la réussite des étapes critiques de la phase 3. De plus, en adoptant une stratégie d'approvisionnement multifournisseurs, les promoteurs d'essais cliniques risquent de passer à côté d'économies importantes liées à l'utilisation d'un seul système d'IA et de traduction par l'IA dans les essais cliniques, notamment :
- Mise à l'échelle centralisée de la traduction
- Synthèse
- Création de contenu
Les stratégies d’approvisionnement multifournisseurs, souvent dictées par les systèmes de gestion de la qualité, contribuent à garantir l’atténuation des risques commerciaux et à obtenir des prix compétitifs. Cependant, la requête de résultats linguistiques auprès de différents prestataires de services linguistiques au sein d’un même programme de développement clinique est déconseillé et sans doute plus risqué qu’une approche centralisée. Les procédures de SQG multifournisseurs entraînent souvent des incohérences et pèsent sur les budgets des essais cliniques. Cela est particulièrement difficile dans un secteur où les coûts de R&D sont scrutés à la loupe.
Les promoteurs d’essais peuvent utiliser l’IA pour les essais cliniques afin de réaliser des économies de coûts supplémentaires, tout en améliorant la qualité et la cohérence linguistiques. Cet objectif peut être mis en œuvre à n’importe lequel de ces niveaux :
- Essai
- Composé
- Thérapeutique
Centralisation des résultats linguistiques pour les études combinées dispositifs-médicaments
Les résultats linguistiques générés par l’IA ne présentent pas uniquement du potentiel au niveau du produit. Les essais cliniques combinent de plus en plus l’étude d’un médicament avec l’étude des performances d’un dispositif de diagnostic in vitro ou avec l'enquête clinique d’un dispositif médical.
Bien qu'un manque d'alignement ait été identifié dans le processus d'autorisation des essais cliniques dans les règlements CTR, RDM et RDMDIV, une approche centralisée des résultats linguistiques peut également améliorer l'efficacité des études combinées. Lionbridge recommande d'utiliser l'IA pour la stratégie linguistique des essais cliniques sur tous les types de contenu pour les études combinées. La terminologie, les ressources linguistiques et le contenu peuvent être partagés sur un dispositif de diagnostic in vitro associé à des médicaments pour faciliter le développement de la médecine personnalisée. Lors du développement du médicament et de son diagnostic compagnon, des flux de travail basés sur l'IA peuvent être prédéfinis et mis en œuvre parallèlement aux glossaires, contribuant ainsi à :
- Améliorer l'efficacité
- Modifier les procédures
- Aligner les communications et les allégations de performances pour prendre en charge les points de terminaison mutuels
Considérez votre prestataire de services linguistiques comme un CRO
Face à l’augmentation des coûts de la recherche clinique, les organismes de recherche clinique (CRO) sont devenus essentiels à la réussite et à l’efficacité des essais cliniques. Au fil du temps, leur rôle a évolué, passant du statut de simples prestataires de services assumant des tâches administratives liées aux essais à celui de véritables partenaires avec une influence sur les aspects suivants :
- Conception de l'essai
- Gestion des données
- Recrutement des patients
L’exécution d’essais numériques et l’IA pour les essais cliniques ont également ouvert de nouvelles opportunités pour des partenariats stratégiques dans le cadre des relations B2B.
Avec les grands modèles de langage (LLM) qui transforment l'ensemble du parcours de contenu, les promoteurs peuvent désormais s'engager dans des partenariats stratégiques similaires avec des prestataires de services linguistiques (PSL) et bénéficier pleinement de l'IA pour les essais cliniques.
Contactez-nous.
Vous souhaitez explorer des solutions linguistiques et de contenu pour faciliter l'ensemble de votre cycle de développement de médicaments et de dispositifs médicaux ? Lionbridge met à votre disposition une expertise multidisciplinaire unique en matière de LLM, d'excellence linguistique, de réglementations et de contenu en sciences de la vie. Nous proposons des solutions d'IA avancées et sur mesure, de la planification à la création, en passant par l'analyse, la synthétisation et la localisation. Contactez-nous.



