

Fallstudie
Neue Lösungen zur KI-Contenterstellung für einen Sport- und Bekleidungsgiganten

- RESSOURCEN
Lionbridge Knowledge Hubs
- LLM-Einschränkungen überwinden
- Positive Patientenergebnisse


Fachleute der Bereiche globale Auftragsvergabe und Outsourcing für klinische Studien müssen zunehmend KI-Lösungen implementieren, um zu transformativen Kosteneinsparungen, höherer betrieblicher Effizienz und einer besseren Überwachung der Kosten klinischer Studien zu gelangen. Klinische Studien sind für die ausufernden Kosten berüchtigt. Die durchschnittlichen Entwicklungskosten vor Markteinführung eines neuen Arzneimittels liegen je nach Therapiebereich zwischen 161 Millionen und 4,54 Milliarden USD. Der Markt für Sprachservices im Bereich der klinischen Life Sciences wird für das Jahr 2019 auf 1,01 Milliarden USD geschätzt. Für den weltweit relevanten Markt für Sprachservices und -technologie liegt die Schätzung für 2023 bei 2,68 Milliarden USD.
Sobald ein Arzneimittelkandidat Phase 1 der Studie erfolgreich durchlaufen hat, wird die klinische Entwicklung multinational und macht umfassende Sprachservices und Lokalisierungen erforderlich, um die globalen Entwicklungspläne für die klinische Phase zu unterstützen. Sponsoren scheuen häufig die Risiken, die mit dem Einsatz von KI für klinische Studien und die Dokumentation der Forschungsergebnisse einhergehen. Dabei revolutioniert KI verschiedene Studienaspekte:
- Design
- Durchführung
- Analyse
Lionbridge ist der festen Überzeugung, dass die EU-Reformen bezüglich der Anträge auf Genehmigung klinischer Studien diese zu einem primären Einsatzbereich für KI in den Life Sciences machen, um insbesondere die sprachlich relevanten Resultate zu unterstützen. Zudem sollten sie bei der Auftragsvergabe im Rahmen strategischer Partnerschaften für Übersetzungsservices in den Liefe Sciences berücksichtigt werden.
Zentrale Einreichung von Dossiers für die gesamte EU: neue Möglichkeiten
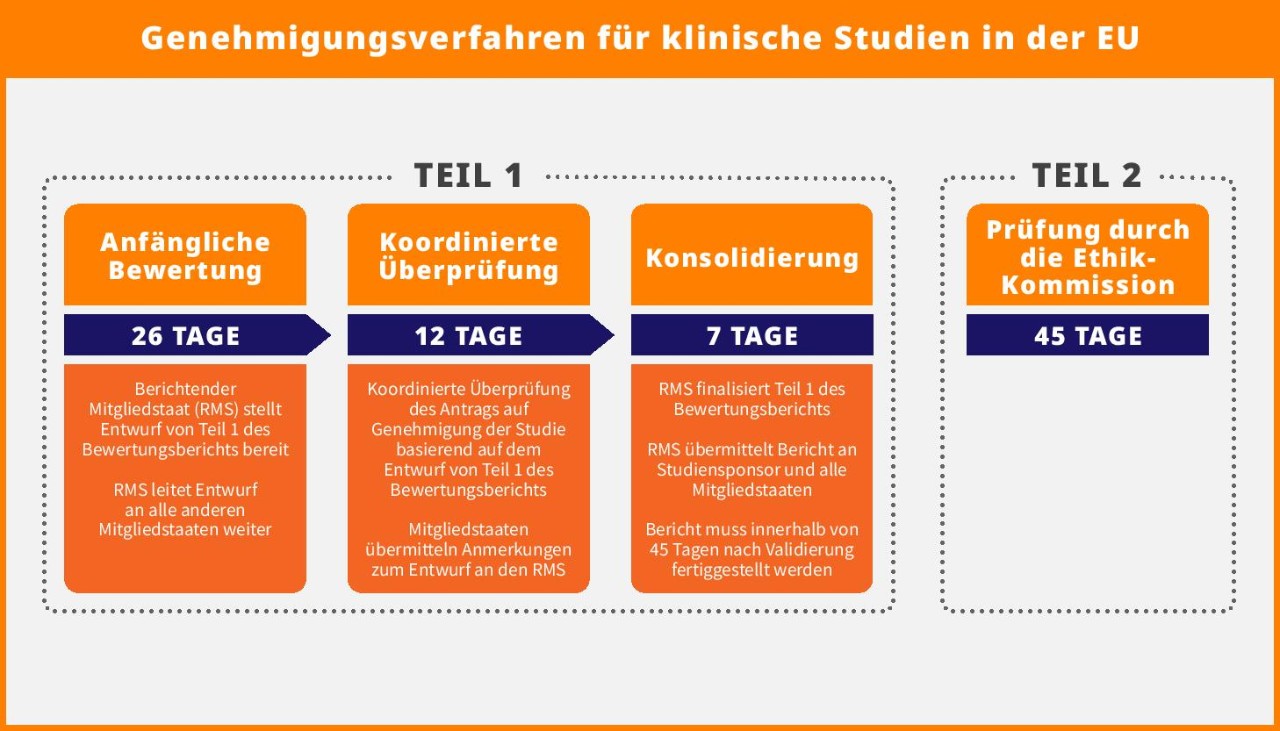
Dank Einführung des CTIS (Clinical Trials Information System) in der EU können Sponsoren klinischer Studien und Hersteller von Medizinprodukten für multinationale Studien in der EU ein einzelnes Antragsdossier einreichen. Die EU-Verordnungen (CTR, MDR und IVDR) und die CTIS-Plattform erleichtern die übergreifende Zulassung in allen EU-Mitgliedstaaten.
Die Genehmigung klinischer Studien wird auf ein 45-tägiges Verfahren reduziert. Dabei agiert ein Mitgliedstaat als RMS (Reporting Member State), der für die koordinierte Bewertung in allen relevanten Mitgliedstaaten verantwortlich ist. Dadurch wird das bisher 60 Tage in Anspruch nehmende Verfahren um 15 Tage verkürzt. Es besteht aus aufeinanderfolgenden Schritten:
- Bewertungsphase: 26 Tage
- Überprüfungsphase: 12 Tage
- Konsolidierungsphase: 7 Tage
Parallel überprüfen die Ethik-Kommissionen aller Mitgliedstaaten in diesem 45-tägigen Bewertungszeitraum Teil 2 des Antragsdossiers.
Die Resultate der koordinierten Phasen zur Überprüfung und Konsolidierung müssen ggf. schnell in linguistischer Hinsicht überarbeitet werden. Gelegentlich fordern Aufsichtsbehörden zusätzliche Informationen in lokalen Sprachen an. Das Studienteam muss schnell auf behördliche Requests for Information (RFI) reagieren und die sprachrelevanten Aktivitäten in allen Ländern managen, um Verzögerungen oder das automatische Verfallen von Genehmigungsanträgen zu vermeiden.
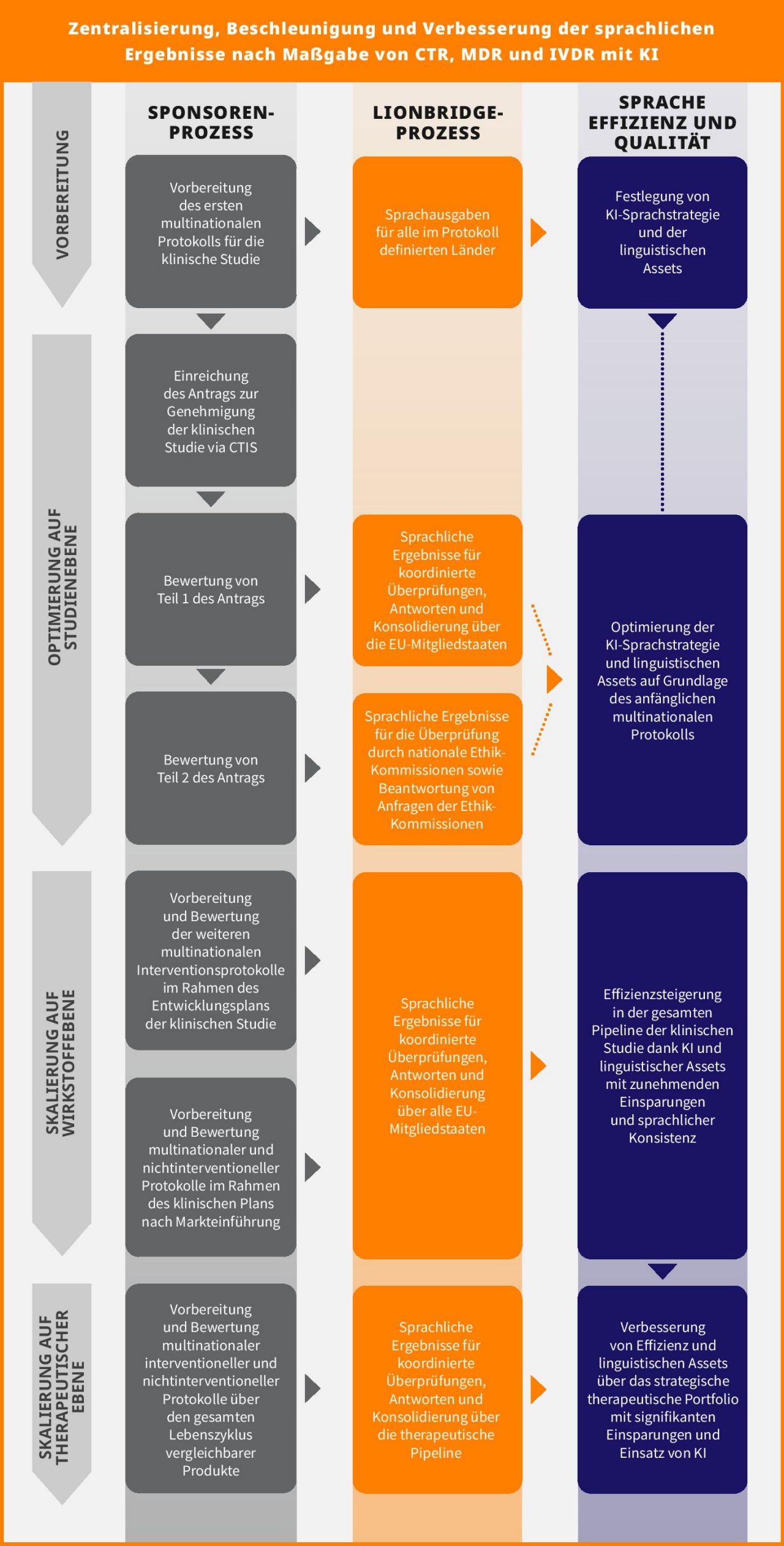
Zentralisierung der Sprachservices: strategisches Gebot für den KI-Einsatz in klinischen Studien
Die strengen Zeitvorgaben und die impliziten Entscheidungsgrundsätze der überarbeiteten EU-Verordnungen sollten für Sponsoren Grund genug sein, Übersetzungsservices für klinische Studien zu zentralisieren. Das Management der Resultate klinischer Studien mittels dezentraler lokaler Managementfunktionen steht im Widerspruch zu den Bemühungen der Regulierungsbehörden, die Genehmigungsverfahren für klinische Studien zu harmonisieren und zu rationalisieren. Angesichts der Vielzahl an Schlüsselstudien, die über mehrere EU-Länder hinweg durchgeführt werden, kann die Dezentralisierung zu einem Risikofaktor für das Erreichen kritischer Meilensteine der Phase 3 werden. Und durch das Festhalten an einer auf mehreren Anbietern basierenden Strategie entgehen den Studiensponsoren zudem erhebliche Kosteneinsparungen, die aus folgenden Aspekten der Verwendung nur eines KI-Systems und der KI-Übersetzung für klinische Studien resultieren:
- Zentrale Skalierung der Übersetzung
- Zusammenfassung
- Contenterstellung
Auf mehreren Anbietern basierende Strategien werden häufig von Qualitätsmanagementsystemen vorgegeben, um Geschäftsrisiken zu mindern und wettbewerbsfähige Preise zu erzielen. Tatsächlich ist aber davon abzuraten, Sprachservices für ein klinisches Entwicklungsprogramm von verschiedenen Sprachdienstleistern zu beziehen, auch aufgrund des erhöhten Risikos. Die unterschiedlichen QMS-Verfahren der Anbieter führen häufig zu Unstimmigkeiten und belasten die Budgets für klinische Studien. Gerade in einer Branche, in der die Kosten für Forschung und Entwicklung kritisch unter die Lupe genommen werden, ist dies problematisch.
Studiensponsoren können KI in klinischen Studien einsetzen, um zunehmende Kosteneinsparungen zu erzielen und gleichzeitig Sprachqualität und -konsistenz zu verbessern. Dieses Ziel kann auf folgenden Ebenen umgesetzt werden:
- Studie
- Wirkstoff
- Therapiegebiet
Zentralisieren der Ergebnisse für kombinierte Arzneimittel-Geräte-Studien in Sprachform
Mit KI-Unterstützung angefertigte Ergebnisse in Sprachform haben nicht nur auf Produktebene großes Potenzial. Klinische Studien vereinen zunehmend die Untersuchung eines Arzneimittels mit der Leistungsstudie eines Geräts für In-vitro-Diagnosen oder der klinischen Prüfung eines Medizinprodukts.
Obwohl die Genehmigungsverfahren für klinische Studien gemäß CTR, MDR und IVDR eine unzureichende Abstimmung aufweisen, kann eine zentrale Herangehensweise an die Ergebnisse in Sprachform auch die Effizienz kombinierter Studien verbessern. Lionbridge empfiehlt die Berücksichtigung von KI in der Sprachstrategie aller kombinierten Studien für alle Arten von Content. Terminologie, Sprachassets und Content für ein Gerät zur In-vitro-Diagnostik können gleichermaßen für das Arzneimittel genutzt werden, um die Entwicklung personalisierter Behandlungen zu unterstützen. Während der Entwicklung eines Arzneimittels und des entsprechenden Diagnostikums können KI-Workflows definiert und zusammen mit den Glossaren implementiert werden, um Folgendes zu erreichen:
- Effizienzsteigerung
- Änderungsverfahren
- Abstimmung von Botschaft und Leistungsversprechen zur Unterstützung gemeinsamer Endpunkte
Behandeln Sie Ihren Sprachdienstleister wie ein CRO
Die steigenden Kosten für klinische Forschung bedeuten auch, dass Auftragsforschungsinstitute (Contract Research Organizations, CRO) für die erfolgreiche und effiziente Durchführung klinischer Studien unverzichtbar geworden sind. Von Dienstleistern, die administrative Aufgaben im Rahmen der Studie übernehmen, haben sich die CRO zu echten Partnern entwickelt, die Einfluss nehmen auf:
- Studiengestaltung
- Datenmanagement
- Patientenrekrutierung
Die digitale Durchführung von und der KI-Einsatz in klinischen Studien eröffnen neue Wege für strategische Partnerschaften in B2B-Beziehungen.
Da Large Language Models (LLM) den gesamten Contentprozess transformieren, können Sponsoren nun ähnliche strategische Partnerschaften mit Sprachdienstleistern (LSP) eingehen und alle Vorteile des KI-Einsatzes für klinische Studien ausschöpfen.
Kontaktieren Sie uns.
Möchten Sie Sprach- und Contentlösungen für den gesamten Lebenszyklus der Arzneimittel- und Medizinproduktentwicklung kennenlernen? Lionbridge bietet einzigartige multidisziplinäre Expertise in Bezug auf LLM, Sprachkompetenz, Vorschriften und Life-Sciences-Content. Wir stellen fortschrittliche und maßgeschneiderte KI-Lösungen bereit – von der Planung über Analyse und Zusammenfassung bis hin zur Lokalisierung. Melden Sie sich bei uns.



