Soluciones de IA
Servicios Adicionales


Caso práctico: marketing multilingüe para minoristas
Nuevas soluciones de creación de contenido con IA para un gigante especializado en prendas y artículos deportivos

- RECURSOS
Centros de conocimiento de Lionbridge
- Liderazgo intelectual en la IA
- Superar las limitaciones del LLM
- Resultados positivos para los pacientes


SELECCIONAR IDIOMA:
Los profesionales de adquisiciones globales y subcontratación clínica se enfrentan una presión cada vez mayor para implementar soluciones de IA que permitan un gran ahorro, aumenten la eficiencia operativa y mejoren las supervisión de los costes de los ensayos clínicos. Los ensayos de investigación clínica son especialmente costosos. La inversión media en I+D necesaria para respaldar un nuevo medicamento antes de su comercialización oscila entre 161 millones y 4540 millones de dólares, en función del área terapéutica. Se calcula que el valor del mercado total de los servicios lingüísticos dentro del ámbito del sector biomédico fue de 1010 millones de dólares en 2019. Se calcula que el volumen del mercado objetivo total global para los servicios y la tecnología lingüística fue de 2680 millones de dólares en 2023.
Una vez que un fármaco candidato supera con éxito los ensayos de fase 1 en humanos, el desarrollo clínico se expande a nivel multinacional y requiere amplios servicios lingüísticos y localización para respaldar los planes de desarrollo clínico globales. Sin embargo, los patrocinadores suelen ser reacios al uso de la IA en los ensayos clínicos y en los resultados lingüísticos de la investigación, a pesar de que la IA ya está revolucionando aspectos clave de los ensayos como:
- Diseño
- Realización
- Análisis
Lionbridge cree firmemente que las reformas de la UE que afectan a las solicitudes de ensayos clínicos son un caso idóneo para aplicar la IA en el sector biomédico, especialmente para mejorar los resultados lingüísticos y para establecer alianzas estratégicas de contratación de servicios de traducción para el sector biomédico.
Expedientes de presentación centralizados en toda la UE: una nueva oportunidad
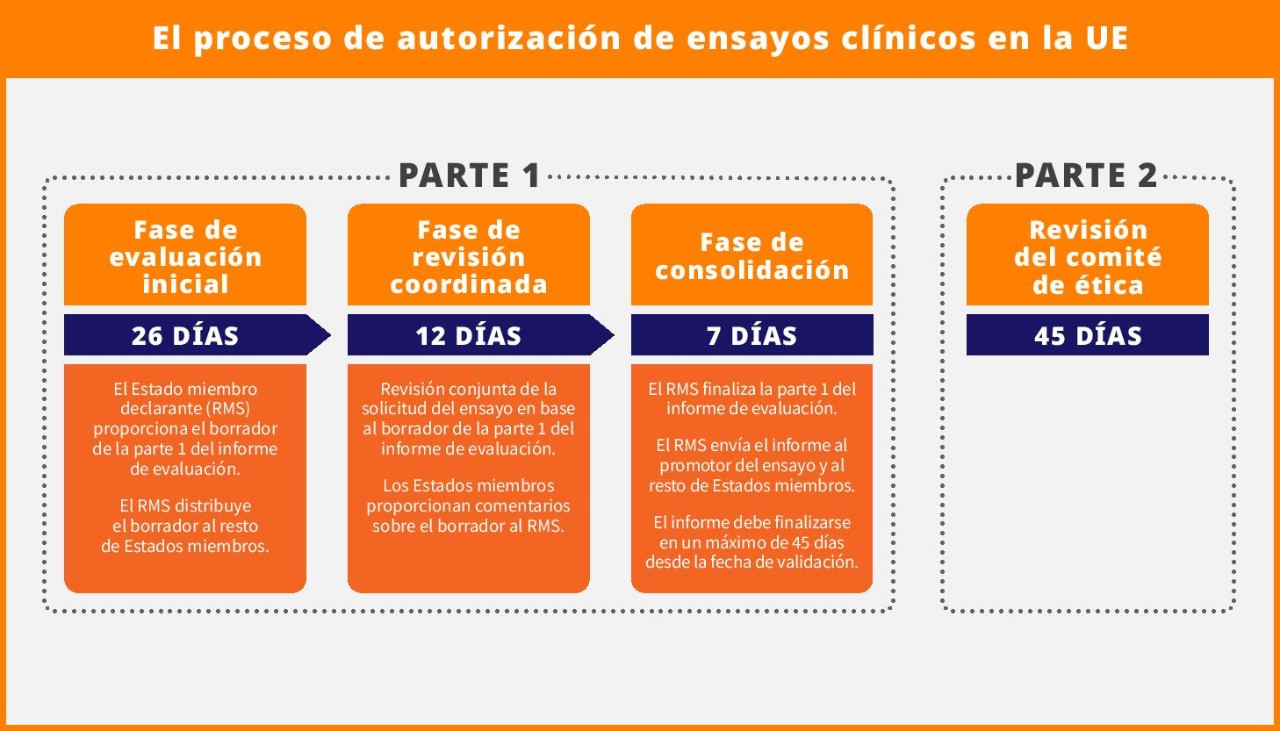
La implementación del Sistema de Información de Ensayos Clínicos (CTIS) de la UE permite a los patrocinadores de ensayos clínicos y a los fabricantes de dispositivos médicos presentar un único expediente de solicitud de ensayo clínico para estudios multinacionales realizados en la UE. Los reglamentos de la UE (REC, RPS y RPSDIV) y la plataforma CTIS facilitan un proceso de autorización conjunto en todos los Estados miembros de la UE.
El proceso de autorización de ensayos clínicos se simplifica en un procedimiento de 45 días, en el que un Estado miembro actúa como Estado miembro notificante (EMN) y es responsable de la evaluación coordinada entre todos los Estados miembros implicados. Este proceso acorta el procedimiento en 15 días, en comparación con los 60 días del proceso anterior. Incluye estos pasos secuenciales:
- Fase de evaluación de 26 días
- Fase de revisión coordinada de 12 días
- Fase de consolidación de 7 días
Paralelamente, durante el mismo período de evaluación de 45 días, los Comités de Ética de cada Estado miembro revisan la Parte 2 del expediente de solicitud.
Los resultados lingüísticos durante las fases de revisión coordinada y consolidación pueden requerir una revisión rápida, o los reguladores pueden solicitar información adicional en los idiomas locales. El equipo del ensayo debe responder con rapidez a las solicitudes de información por parte de los organismos reguladores y gestionar ágilmente las actividades lingüísticas en todos los países para evitar demoras o la caducidad automática de las solicitudes.
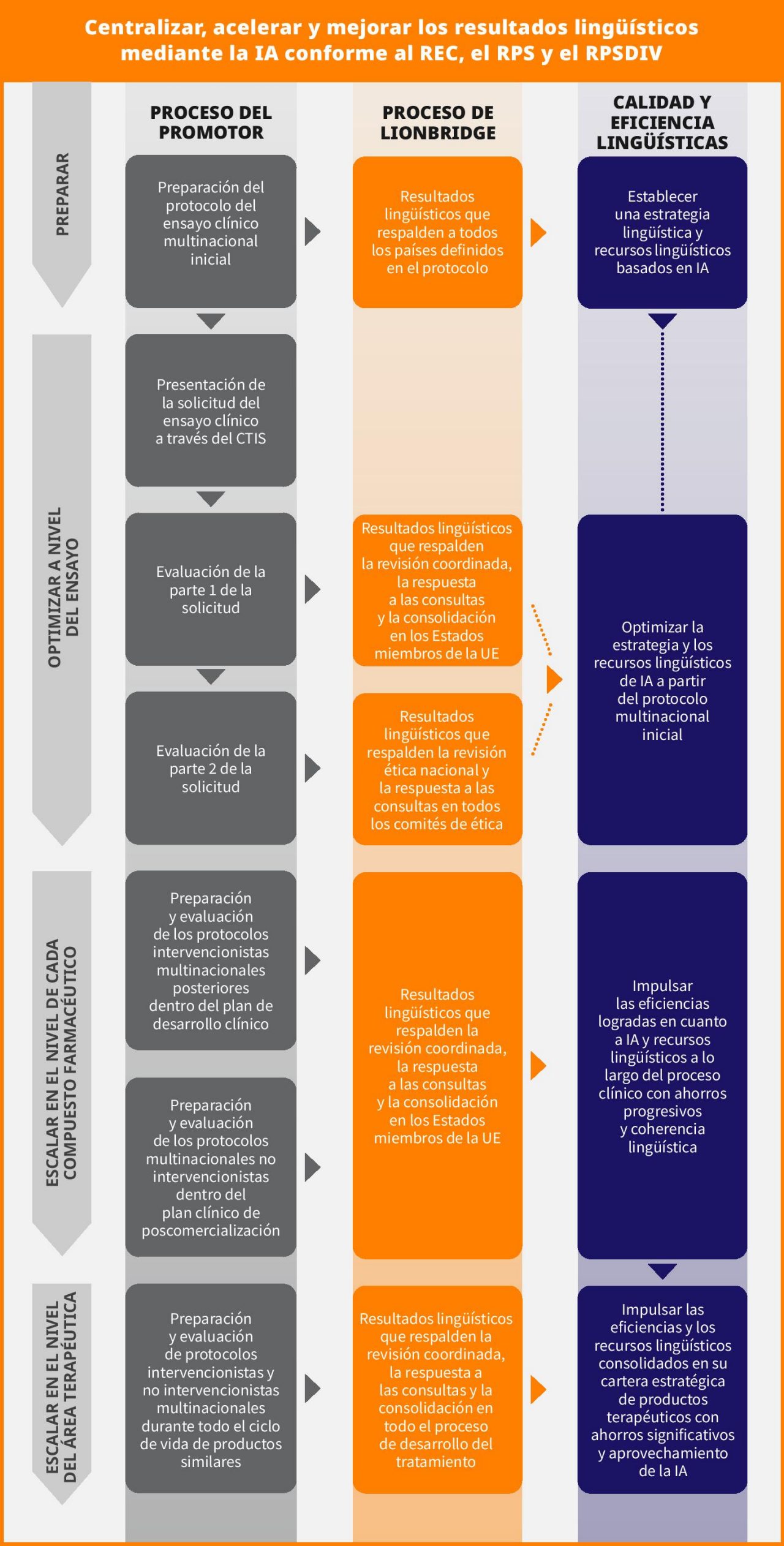
Centralización de los servicios lingüísticos: un imperativo estratégico para el uso de la IA en ensayos clínicos
Los plazos estrictos y los principios de decisión implícitos en los nuevos reglamentos de la UE deberían alentar a los patrocinadores a centralizar los servicios de traducción de ensayos clínicos. La gestión de los resultados lingüísticos a través de funciones de gestión de ensayos locales descentralizadas contradice los esfuerzos de los reguladores por armonizar y agilizar los procedimientos de autorización de ensayos clínicos. Dado que se están realizando numerosos estudios fundamentales en varios países de la UE, la descentralización puede convertirse en un factor de riesgo para alcanzar los hitos críticos de la fase 3. Además, al mantener una estrategia de adquisiciones con múltiples proveedores, los patrocinadores de ensayos clínicos pueden perderse importantes ahorros derivados del uso de un único sistema de IA y de la traducción con IA de ensayos clínicos, entre ellos:
- Escalado centralizado de la traducción
- Resumen
- Creación de contenido
Las estrategias de compra a múltiples proveedores, a menudo dictadas por los sistemas de gestión de calidad, ayudan a garantizar la mitigación del riesgo empresarial y a obtener precios competitivos. Sin embargo, obtener resultados lingüísticos de diferentes proveedores de servicios lingüísticos dentro del mismo programa de desarrollo clínico es desaconsejable y posiblemente más arriesgado que usar un enfoque centralizado. Seguir procedimientos de QMS de múltiples proveedores a menudo genera resultados incoherentes y sobrecarga los presupuestos de ensayos clínicos. Esto es especialmente problemático en una industria en las que se analizan minuciosamente los costes de I+D.
Los patrocinadores de ensayos pueden usar la IA en ensayos clínicos para obtener un ahorro de costes incremental, además de para mejorar la calidad y la coherencia lingüística. Este objetivo se puede implementar en cualquiera de estos niveles:
- Ensayo
- Compuesto
- Terapéutico
Centralización de los resultados lingüísticos para estudios combinados de fármacos y dispositivos
Los resultados lingüísticos respaldados por la IA no solo tienen potencial en el nivel de producto. Los ensayos clínicos combinan cada vez más la investigación de un medicamento con el estudio del rendimiento de un dispositivo de diagnóstico in vitro o una investigación clínica de un dispositivo médico.
Si bien se ha identificado una falta de correspondencia en el proceso de autorización de los ensayos clínicos entre el reglamento sobre ensayos clínicos (REC), el reglamento sobre productos sanitarios (RPS) y el reglamento sobre productos sanitarios de diagnóstico in vitro (RPSDIV), un enfoque centralizado de los resultados lingüísticos también puede mejorar la eficiencia de los estudios combinados. Lionbridge recomienda utilizar IA para la estrategia lingüística de ensayos clínicos en todos los tipos de contenido para estudios combinados. Se pueden compartir terminologías, recursos lingüísticos y contenido en un dispositivo de diagnóstico in vitro combinado con medicamentos para respaldar el desarrollo de medicamentos personalizados. Durante el desarrollo del fármaco y su diagnóstico complementario, se pueden predefinir e implementar flujos de trabajo de IA junto con glosarios, lo que ayuda a:
- Impulsar la eficiencia
- Cambiar los procedimientos
- Alinear los mensajes y las declaraciones de rendimiento para respaldar objetivos comunes
Trate a su proveedor de servicios lingüísticos como una CRO
Con el aumento de los costes de la investigación clínica, las CRO (organizaciones de investigación por contrato) se han vuelto esenciales para la ejecución correcta y eficiente de los ensayos clínicos. Con el tiempo, su papel ha evolucionado de ser prestadores de servicios encargados de tareas administrativas relacionadas con los ensayos a convertirse en verdaderos socios estratégicos que influyen en los siguientes aspectos:
- Diseño de ensayos
- Gestión de datos
- Selección de pacientes
La ejecución de ensayos digitales y el uso de la IA para ensayos clínicos también han abierto nuevas vías para alianzas estratégicas en la relación entre empresas.
Dado que los modelos lingüísticos de gran tamaño (LLM) están transformando por completo el proceso de creación de contenido, los promotores tienen ahora la posibilidad de crear asociaciones estratégicas similares con proveedores de servicios lingüísticos (LSP) y sacar el máximo partido de la IA para los ensayos clínicos.
Póngase en contacto con nosotros.
¿Listo para explorar soluciones lingüísticas y de contenido que respalden todo el ciclo de vida del desarrollo de medicamentos y dispositivos médicos? Lionbridge ofrece una experiencia multidisciplinar única en lo que respecta a LLM, excelencia lingüística, reglamentos y contenido en el sector biomédico. Ofrecemos soluciones de IA avanzadas y personalizadas, desde la planificación hasta la creación, el análisis, el resumen y la localización. Póngase en contacto con nosotros.



