SPRACHE:
- WAS WIR TUN
- KI
Lionbridge Knowledge Hubs
- Positive Patientenergebnisse
- Die Zukunft der Lokalisierung

- BRANCHEN

Content-Services
- Technische Redaktion
- Schulungen
- Finanzberichte
- Digitales Marketing
- Content für SEO
Übersetzung und Lokalisierung
- Videolokalisierung
- Software-Lokalisierung
- Website-Lokalisierung
- Übersetzung für regulierte Branchen
- Dolmetschen
- Live Events
Testdienstleistungen
- Testservice
- Kompatibilitätsprüfungen
- Interoperabilitätsprüfungen
- Performance-Tests
- Zugänglichkeits-Tests
- Überprüfen des Kundenerlebnisses
Lösungen
- Übersetzungsservices
- Maschinelle Übersetzung
- Smart Onboarding™
- Aurora AI Studio™
Unsere Knowledge Hubs
- Positive Patientenergebnisse
- Die Zukunft der Lokalisierung
- Mit Innovation zur Immunität
- Covid-19-Sprachressourcen
- Disruption Series
- Patienteneinbindung
- Lionbridge Insights
- Pharma-Übersetzungen
- Klinisch
- Regulierung
- Nach der Zulassung
- Für Unternehmen
- Medizinprodukte-Übersetzungen
- Validierung/Klinische Studien
- Regulierung
- Nach der Autorisierung
- Für Unternehmen
Bank- und Finanzwesen
Einzelhandel
Luxusgüter
E-Commerce
Lionbridge Games
Automobilbranche
Konsumgüter
Technologie
Maschinenbau und Fertigung
Rechtsdienstleistungen
Tourismus und Gastgewerbe
SPRACHE AUSWÄHLEN:
Im Jahr 2017 wurden zwei neue europäische Verordnungen auf EUR-Lex veröffentlicht. Damit wurde die Welt für Medizinproduktehersteller, die ihre Produkte auf den europäischen Markt bringen wollen, auf den Kopf gestellt. Die MDR (Medizinprodukteverordnung, Medical Device Regulation) und die IVDR (Verordnung für In-vitro-Diagnostika, In-vitro-Diagnostic Device Regulation) ersetzen alte Medizinprodukterichtlinien aus den 1990er Jahren. Mit dem Datum des Inkrafttretens der IVDR am 26. Mai 2022 ist die Übergangszeit für diese beiden neuen Verordnungen beendet. Die Verordnungen sind nun in vollem Umfang in Kraft, auch wenn für einige wenige Produkte Ausnahmeregelungen gelten, so dass sie für eine weitere „Gnadenfrist” auf dem Markt bleiben können.
Der 26. Mai 2022 markiert auch den ersten Jahrestag des Inkrafttretens der MDR. Im vergangenen Jahr hat Lionbridge gemeinsam mit seinen MedTech-Kunden nach geeigneten und flexiblen Lösungen für die sprachlichen Herausforderungen gesucht, die sich aus den regulatorischen Anforderungen dieser neuen Reformen ergeben. Die Reise hat gerade erst begonnen, und wir sind bestrebt, unsere Kunden bei der Zentralisierung von Übersetzungen und der Nutzung von Sprachressourcen während des gesamten Lebenszyklus von Produkten zu unterstützen.

Beide Verordnungen verlangen, dass lebenslange Kontrollen des Produktportfolios der Hersteller durchgeführt und die Leistung und Sicherheit von Produkten über die EUDAMED-Datenbank (Europäische Datenbank für Medizinprodukte) öffentlich bekanntgegeben werden müssen. Es gab noch nie einen passenderen Zeitpunkt für MedTech-Hersteller, die Sprachstrategie für ihr gesamtes Produktportfolio zu überdenken.
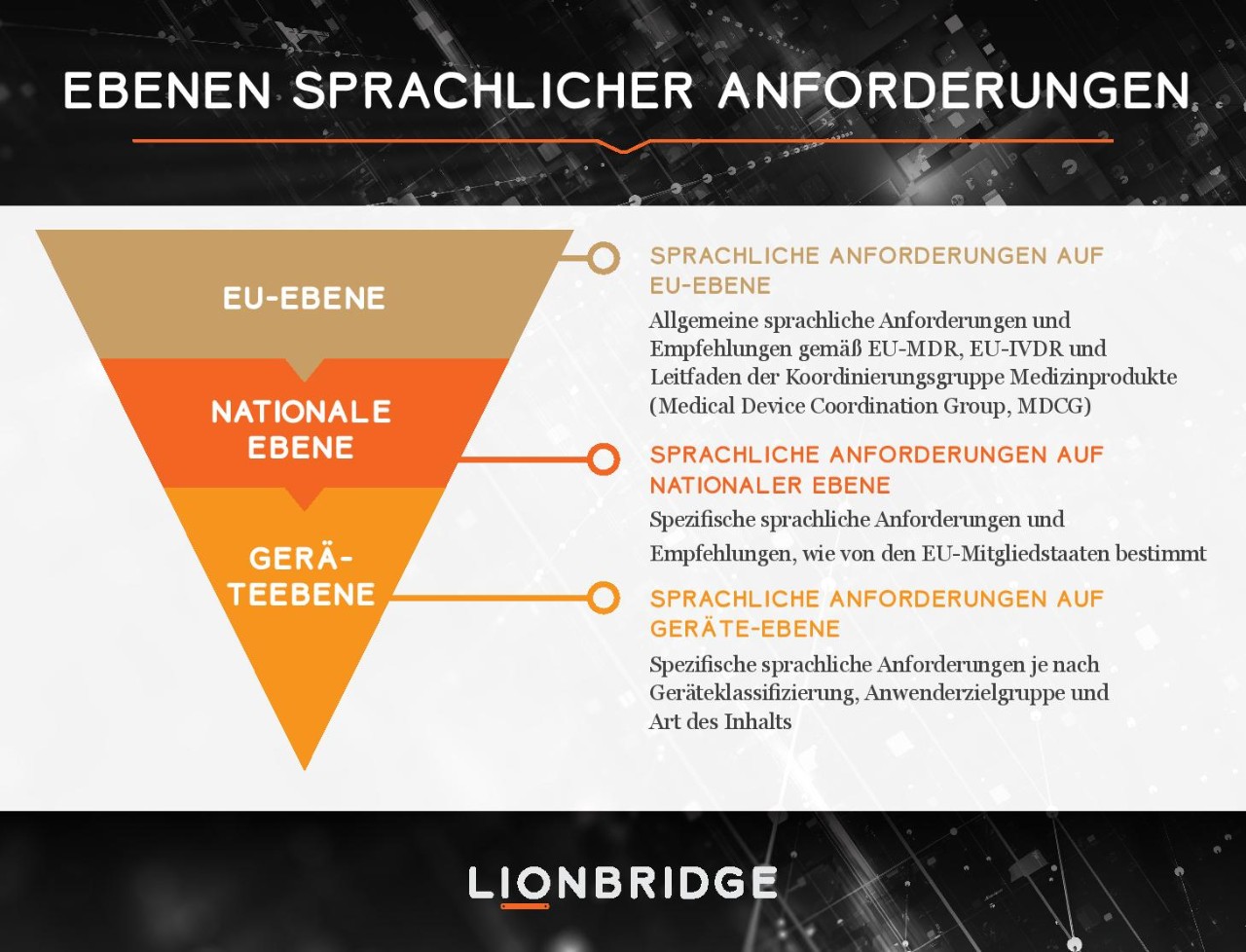
Die MDR und die IVDR stellen die Hersteller vor ähnliche inhaltliche und sprachliche Herausforderungen. Diese Arbeitsbelastung ist auf die Zunahme neuer Dokumentationsanforderungen während des Produktlebenszyklus für beide Gerätetypen sowie auf neue Transparenzanforderungen für medizinische Technologien auf dem EU-Markt zurückzuführen.
Lionbridge hat in seiner MDR-Reihe immer wieder seine Ansichten geäußert und Empfehlungen dazu gegeben, wie Hersteller Sprachbarrieren bewältigen können. Mit der Veröffentlichung unseres neuen IVDR-Whitepapers haben wir unsere Erkenntnisse auf diese neue Verordnung ausgeweitet.

Wir sprechen weiterhin die Empfehlung aus, dass die Hersteller Übersetzungen und Sprachressourcen zusammen mit anderen Aktivitäten der Geräteentwicklung und Designkontrolle planen sollten.
Die EU ist ein mehrsprachiger Raum. Obwohl die Harmonisierung ein wichtiger Anreiz für die Aufwertung der alten EU-Richtlinien zu Verordnungen war, ist die Sprache nach wie vor eine nationale Angelegenheit, die von jeder zuständigen nationalen Behörde entschieden wird. Wir ermutigen die Hersteller, Sprache als eine vielschichtige Aktivität einzustufen, mit der die Sprache ihres gesamten Produktportfolios kontrolliert und optimiert werden kann.