

- リソース


グローバルな調達および臨床アウトソーシングの専門家は、大胆なコスト削減、運用の効率化、臨床試験コストの効果的な監視を促進する AI ソリューションの導入に対して、ますますプレッシャーを感じています。臨床研究試験は、費用が高額になることがよく知られています。新薬の発売までにかかる平均研究開発 (R&D) コストは、治療領域に応じて 1 億 6,100 万ドルから 45 億 4,000 万ドルに及びます。臨床ライフ サイエンス分野における言語サービス市場全体の規模は、2019 年時点で 10 億 1,000 万ドルと推定されています。また、2023 年の言語サービスおよびテクノロジーに関する世界全体の獲得可能な市場規模は 26 億 8,000 万ドルと推定されています。
候補薬がフェーズ 1 のヒト臨床試験に合格すると臨床開発は多国籍化の段階に入るため、広範な言語サービスとローカリゼーションを展開して、グローバルな臨床開発計画を支える必要性が出てきます。AI はすでに臨床試験の以下の領域で革命をもたらしていますが、臨床試験依頼者は臨床試験や研究に関する文章/翻訳生成に AI を活用することについては、リスクを回避しようとする傾向があります。
- デザイン
- 実施
- 分析
ライオンブリッジは、臨床試験申請に関する EU の改革が、特に文章/翻訳生成を目的としたライフ サイエンスにおける AI の活用、そしてライフ サイエンス翻訳サービスとの戦略的調達パートナーシップの最適な事例であると確信しています。
EU 全体での提出書類の一元化: 新しい機会
臨床試験依頼者や医療機器メーカーは、EU で臨床試験情報システム (CTIS) を導入することで、臨床試験申請書類を 1 件提出するだけで EU で多国試験を実施できるようになります。EU の規則 (CTR、MDR、IVDR) と CTIS プラットフォームを組み合わせることで、すべての EU 加盟国にわたる共同承認プロセスが円滑化されます。
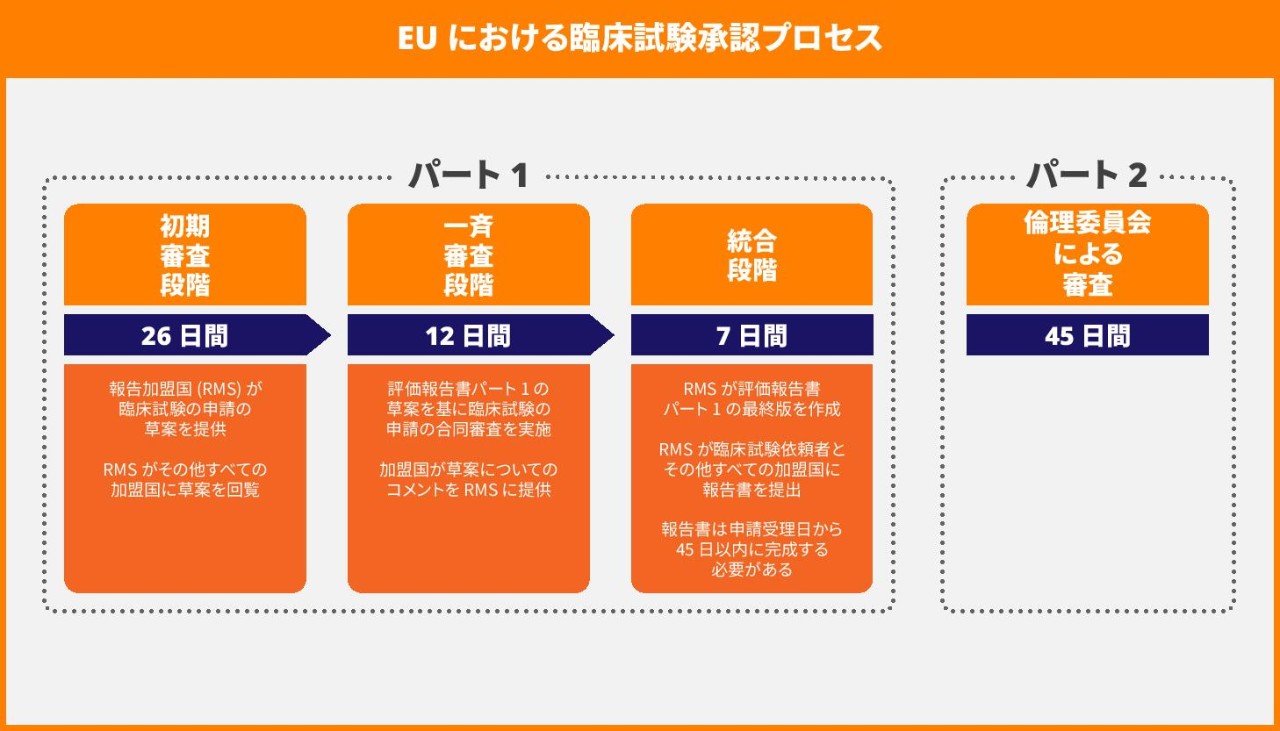
臨床試験の承認プロセスは 45 日間の手続きに簡素化されており、1 つの加盟国が、報告加盟国 (RMS: Reporting Member State) として機能し、関係するすべての加盟国間の審査を調整する役割を担います。以前の 60 日間のプロセスに比べて、このプロセスでは手続きが 15 日間短縮されます。これには、次の一連の手順が含まれます。
- 26 日間の審査段階
- 12 日間の一斉審査段階
- 7 日間の統合段階
これらと並行して、同じ 45 日間の審査期間で、各加盟国の倫理委員会が申請書類のパート 2 を審査します。
文章/翻訳生成については、一斉審査段階や統合段階で迅速な修正が必要になる場合があり、また、規制当局から現地の言語での追加情報の提出を求められる場合もあります。臨床試験チームは、提出の遅延や申請の自動失効を避けるために、規制当局の情報要求に迅速に対応し、すべての国にわたる言語関連の作業を効率的に管理する必要があります。
言語サービスの一元化: 臨床試験向け AI に関する戦略的要件
改訂された EU 規格には、厳格なタイムラインと「暗黙の決定」の原則が含まれていることから、臨床試験依頼者が臨床試験の翻訳サービスを一元化することが促進されると考えられます。分散型のローカル試験管理機能を使用して文章/翻訳生成を管理することは、臨床試験承認手順の調和と合理化を目指す規制当局の取り組みと矛盾します。多数の重要な研究が複数の EU 加盟国にまたがって実施されているため、分散型は重要な第 3 段階のマイルストーンを達成するうえでリスク要因になる可能性があります。また、マルチベンダー調達戦略に固執した場合、臨床試験依頼者は、臨床試験において単一の AI システムと AI 翻訳を次のような目的で使用することで得られる大幅なコスト削減の機会を逃す可能性があります。
- 翻訳の拡張の一元化
- 要約
- コンテンツ作成
多くの場合、品質管理システムに基づいて決定されるマルチベンダー調達戦略は、ビジネス リスクの軽減や競争力のある価格の実現に役立ちます。ただし、1 つの臨床開発プログラム内で異なる言語サービス プロバイダーから文章/翻訳生成を調達することは、一元化されたアプローチよりもリスクが高いと言えます。マルチベンダーの QMS 手順に従うと、一貫性が損なわれ、臨床試験のコストが増加することがよくあります。これは、R&D コストを厳しく精査する業界において、特にやっかいな問題になります。
臨床試験依頼者は臨床試験向け AI を活用することで、言語の品質と一貫性を向上させながら、段階的なコスト削減を実現できます。この目標は、次のどのレベルにおいても実現できます。
- 試験
- 化合物
- 治療
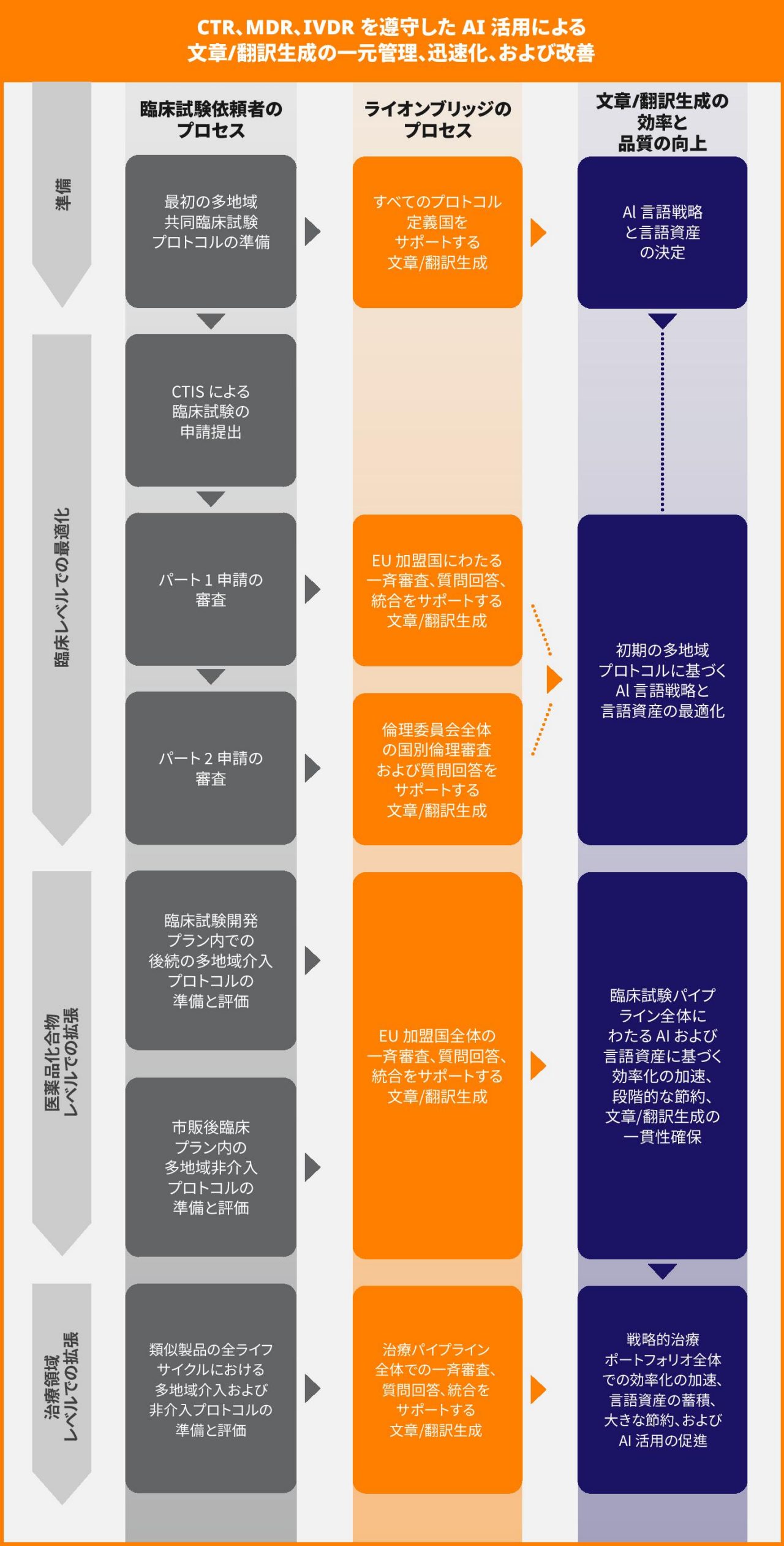
医薬品と医療機器の複合試験における文章/翻訳生成の一元化
AI がサポートする文章/翻訳生成の可能性は、製品レベルにとどまりません。臨床試験では、医薬品についての試験と、体外診断用医療機器の性能試験または医療機器の臨床試験が組み合わせて実施されることが増えています。
CTR、MDR、IVDR に基づく臨床試験承認プロセスでは、整合性の欠如が確認されていますが、文章/翻訳生成に対する一元化されたアプローチを採用することで、複合試験の効率が促進されます。ライオンブリッジは、複合試験のすべてのコンテンツ タイプにわたって、臨床試験向け AI による言語戦略を採用することを推奨しています。用語、言語資産、コンテンツを体外診断用医療機器と医薬品との組み合わせごとに共有し、パーソナライズされた医薬品開発を支援します。医薬品とそれに関連する診断用機器の開発中に、AI ワークフローを用語集とともに事前に定義して実装することで、次のような効果が得られます。
- 効率化の促進
- 手順の変更
- メッセージと性能主張の整合性確保による、共通の評価項目のサポート
CRO としての言語サービス プロバイダー
臨床研究コストが高騰する中、臨床試験を適切かつ効率的に実施するには、契約研究機関 (CRO) の存在が不可欠となっています。時間の経過とともに、CRO の役割は、臨床試験の管理業務を担当するサービス プロバイダーから、次のような分野についての影響力を持つ真のパートナーへと進化しました。
- 試験デザイン
- データ管理
- 被験者の募集
デジタル臨床試験の実施と臨床試験向け AI は、B2B 関係全体にわたる戦略的パートナーシップの新たな道も開きました。
大規模言語モデル (LLM) によってコンテンツ制作プロセス全体が変革されたことで、臨床試験依頼者は、同様の戦略的パートナーシップを言語サービス プロバイダー (LSP) と結び、臨床試験向け AI のメリットを最大限に活用することができます。
お問い合わせ
医薬品および医療機器の開発ライフサイクル全体をサポートする言語・コンテンツ ソリューションをご検討であれば、当社までぜひご相談ください。ライオンブリッジでは、さまざまな分野を対象として、LLM、言語エクセレンス、規制、ライフ サイエンス コンテンツに関する独自の専門知識とサービスを提供しています。企画から制作、分析、要約、ローカリゼーションまで、高度かつカスタムメイドの AI ソリューションをご提供いたします。皆様からのお問い合わせをお待ちしております。




