- VAD VI GÖR
Ytterligare tjänster

- Branscher

Fallstudie: Flerspråkiga kampanjer i detaljhandeln
Nya AI-baserade lösningar för skapande av innehåll hos stort sport- och klädföretag

- RESURSER

- OM OSS

Startsida: Vad vi gör
Generativ AI
– AI-översättningstjänster
– Content Remix
AI-datatjänster
– Aurora AI Studio™
Maskinöversättning
– Lionbridges bedömningsverktyg för MT
Onboarding av kunder
Tjänstemodeller för översättning
Innehållstjänster
– Teknisk dokumentation
– eLearning och utbildning
– Finansiella rapporter
– Digital marknadsföring
– SEO och innehållsoptimering
Översättningstjänster
– Videolokalisering
– Lokalisering av programvara
– Lokalisering av webbplatser
– Översättning för reglerade företag
– Tolkning
– Liveevenemang
– Language Quality Services
Testningstjänster
– Funktionstestning av spel
– Kompatibilitetstestning
– Interoperabilitetstestning
– Prestandatestning
– Tillgänglighetstestning
– Testning av användargränssnitt och kundupplevelse
Startsida: Branscher
Översättning för Life Sciences
– Översättning för läkemedelsindustrin
– Översättning för kliniska prövningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för läkemedelsindustrin
– Språktjänster för medicintekniska produkter
– Validering och kliniska undersökningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för tillverkare av medicintekniska produkter
Bank och finans
Detaljhandel
Lyxprodukter
E-handel
Lionbridge Games
Fordonsindustri
Konsumentförpackade varor
Teknik
Tillverkningsindustri
Juridiska tjänster
Resor, hotell och restaurang
Insikter
– Blogginlägg
– Fallstudier
– Faktablad
– Lösningsöversikter
– Infografik
– e-böcker
– Videor
Webbinarier
Lionbridges kunskapscenter
– Positiva patientutfall
– Moderna lösningar för kliniska prövningar
– Patientengagemang
- Tankeledarskap inom AI
VÄLJ SPRÅK:
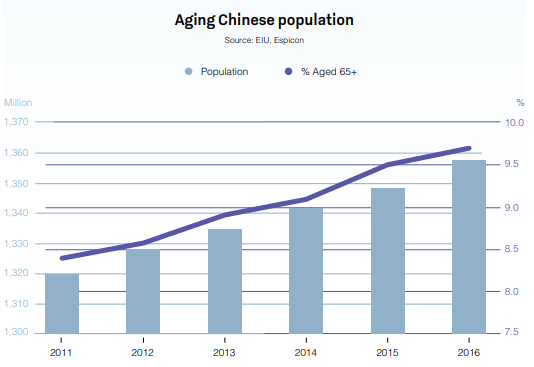
Kina är en stormakt inom många globala branscher.
Landet, som har en beräknad befolkning för 2019 på 1,42 miljarder, kommer att fortsätta prägla de globala marknaderna långt in i framtiden. En sådan marknad? Läkemedel.
Den kinesiska läkemedelsmarknaden genomgår omfattande regulatoriska förändringar som skulle kunna främja mer klinisk forskning och läkemedelslanseringar i Kina. Kinas läkemedelsmyndighet (NMPA) har gått med i ICH (International Council for Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use). I och med medlemskapet följer nu Kina den internationella läkemedelsbranschens standarder, vilket ökar den internationella harmoniseringen av läkemedelsutveckling och genomförandet av kliniska prövningar.
Kina har även nyligen omstrukturerat sitt regulatoriska system med målet att främja och underlätta utvecklingen och frisläppandet av läkemedel.
Dessa förändringar påskyndar tillväxten inte bara i Kina, utan i hela världen.
Här är tre följder av de regulatoriska förändringarna på den kinesiska läkemedelsmarknaden för resten av världen.
1. Den snabbare takten på den kinesiska läkemedelsmarknaden ger globala läkemedelsföretag nya möjligheter
Kina är redan världens näst största läkemedelsmarknad med en omsättning på 573 miljarder USD och kommer att fortsätta växa långt in på 2020-talet. Kinas stora och åldrande befolkning, en växande inkomst per capita och de ökade hälsoutgifterna har lett till en tillväxt på upp till 30 % jämfört med samma period föregående år.
Regulatoriska förändringar gör det nu lättare för globala läkemedelsföretag som länge har velat sälja sina produkter på denna lovande, men till stor del ännu outnyttjade marknad. Kinas gamla regulatoriska krav krävde att kliniska prövningar som utfördes i Kina omfattade kinesiska patienter och tester på lokala laboratorier, vilket tvingade läkemedelsföretagen att genomföra hela fristående fas 3-studier i Kina efter lanseringen i USA och EU. Detta för att undvika en fördröjd lanseringstid på dessa marknader.
Med de regulatoriska förändringarna – och med en stor, behandlingsnaiv population att rekrytera prövningsdeltagare från – kan kommande prövningar genomföras i Kina parallellt med lanseringarna i USA och EU. Det kommer att gynna både de kinesiska patienterna, som får de läkemedel de behöver snabbare, och de globala läkemedelsföretagen som tillverkar läkemedlen.
Det blir intressant att se de närmaste åren om dessa systemförändringar får någon effekt, och i så fall vilken, på planeringen av den kliniska utvecklingen och de regulatoriska strategierna hos läkemedelsföretagen som vill sälja sina produkter i Kina.
2. De regulatoriska förändringarna kan leda till färre överflödiga kliniska prövningar och mindre onödiga risker för patienterna
I och med medlemskapet i ICH följer nu Kina de internationella GxP-standarderna (t.ex. god tillverkningssed (GMP) och god klinisk sed (GCP)) som tillämpas i stora delar av den internationella läkemedelsbranschen. Det innebär även att kliniska data från Kina och ICH-länder under läkemedelsutvecklingen accepteras bilateralt av kinesiska och internationella regulatoriska myndigheter.
Dessa förändringar är viktiga för harmoniseringen av regulatoriska krav och för att underlätta läkemedelsutvecklingen, men de har även en nyckelroll när det gäller att undvika överflödiga eller upprepade kliniska prövningar som utsätter patienter för onödiga risker. Reformerna i det kinesiska regulatoriska systemet liknar de reformer som vi ser på andra globala marknader: de har som mål att ge sina invånare snabbare och bättre tillgång till nya och innovativa behandlingar.
3. Omfattningen och tempot för de kliniska prövningarna i Kina kommer att öka snabbt
Ett resultat av de regulatoriska omstruktureringarna i Kina som verkar vara säkert är att omfattningen och tempot för de kliniska prövningarna som utförs i Kina kommer att öka i rasande takt de närmaste åren. De kinesiska regulatoriska myndigheterna har gjort förändringar som snabbar på regulatoriska granskningar, innebär nya och mindre stränga policyer för import av läkemedel till Kina, erbjuder garanterade marknadsexklusivitetsperioder för specifika produkter (t.ex. genom slopade avgifter på importerade cancerläkemedel) och ger avsevärda förbättringar i tidsplanerna för kliniska prövningar i Kina.
Hittills har det tagit mellan ett och tre år att få ett godkännande för en klinisk prövning i Kina. Den väntetiden förväntas minska avsevärt – till 60 arbetsdagar. I princip innebär det att prövningssponsorer kan skicka in ansökningar och lägga upp tidsplaner parallellt i både EU och Kina.
Dessutom ska NMPA införa prioritetsgranskningar av vissa läkemedel i syfte att snabba på lanseringstiden och göra det lättare för patienter att snabbare få tillgång till livsnödvändiga läkemedel (t.ex. för innovativa behandlingar, avancerad teknik eller behandlingar med stora kliniska fördelar för sjukdomar som HIV, tuberkulos, hepatit, sällsynta sjukdomar eller elakartade tumörer samt pediatriska läkemedel). NMPA kommer även att acceptera kliniska data från andra länder vid godkännande för försäljning.
Dessa förändringar uppmuntrar till utveckling och försäljning av nya läkemedel och öppnar upp för nya möjligheter för läkemedelstillverkare, prövningssponsorer och – viktigaste av allt – patienterna.
Oavsett bransch är det ett smart drag för företag att hålla ett öga på Kina. Regulatoriska förändringar i läkemedelsbranschen som ger nya, stora möjligheter innebär också stora utmaningar för läkemedelsföretag som vill genomföra kliniska prövningar och marknadsföra läkemedel på den kinesiska marknaden på ett snabbt och effektivt sätt.
Fler prövningar och kortare tidsramar innebär mer innehåll, fler översättningar och ett ökat behov av en samarbetspartner med erfarenhet, global räckvidd och skalbarhet. Lionbridge har varit den partnern i många år. Vi är alltid redo att bryta ny mark tillsammans med dig, med det gemensamma målet att snabbare förse fler människor med säkra läkemedel på fler platser. Kontakta oss idag för mer information om hur vi kan hjälpa dig att ta dig in på nya marknader, i både Kina och resten av världen.