IDIOMA:
- QUÉ HACEMOS
- IA
Centros de conocimientos de Lionbridge
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad

- SECTORES

Servicios de contenido
- Redacción técnica
- Formación y aprendizaje electrónico
- Informes financieros
- Marketing digital
- SEO y optimización de contenido
Servicios de traducción
- Localización de vídeo
- Localización de software
- Localización de sitios web
- Traducción para empresas reguladas
- Interpretación
- Eventos en directo
Servicios de pruebas
- Pruebas y controles de calidad funcionales
- Pruebas de compatibilidad
- Pruebas de interoperabilidad
- Pruebas de rendimiento
- Pruebas de accesibilidad
- Prueba UX/CX
Soluciones
- Modelos de servicio de traducción
- Traducción automática
- Smart Onboarding™
- Aurora AI Studio™
Nuestros Centros de conocimientos
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad
- Centro de recursos lingüísticos para la COVID-19
- Serie Tiempos de cambio
- Compromiso del paciente
- Monográficos de Lionbridge
Sector biomédico
- Sector farmacéutico
- Aspectos clínicos
- Cuestiones normativas
- Actividades posteriores a la aprobación
- Ámbito corporativo
- Productos sanitarios
- Validación e investigaciones clínicas
- Cuestiones normativas
- Actividades posteriores a la autorización
- Ámbito corporativo
Banca y finanzas
Minorista
Lujo
Comercio electrónico
Lionbridge Games
Automoción
Bienes de consumo envasados
Tecnología
Fabricación industrial
Servicios jurídicos
Viajes / Hostelería
SELECCIONAR IDIOMA:
China es una potencia en auge en todos los sectores globales.
El país (con una población en 2019 de 1420 millones de habitantes) está en condiciones de seguir alterando los mercados globales durante mucho tiempo. ¿Un ejemplo de esos mercados? El farmacéutico.
El mercado farmacéutico chino está experimentando importantes cambios normativos que podrían facilitar la realización de más investigaciones clínicas y lanzamientos de fármacos en China. La Administración Nacional de Productos Médicos de China (NMPA) se ha sumado al Consejo Internacional de armonización de los requisitos técnicos para el registro de medicamentos de uso humano (ICH, por sus siglas en inglés). Con esta adhesión, China sigue ahora los estándares de prácticas recomendadas internacionales de la industria farmacéutica, lo que permite aumentar la armonización internacional de los procesos de desarrollo de medicamentos y realización de ensayos clínicos.
Además, China ha reestructurado recientemente su sistema regulador con la finalidad de incentivar y acelerar el desarrollo y lanzamiento de medicamentos.
Estos cambios son catalizadores para el crecimiento, no solamente en China, sino en todo el mundo.
Estas son las tres consecuencias para el mundo de los cambios normativos del mercado farmacéutico chino.
1. La aceleración del mercado farmacéutico chino presenta oportunidades para las empresas farmacéuticas de todo el mundo
China es ya el segundo mercado farmacéutico del mundo, valorado en 573 000 millones de dólares, y seguirá creciendo durante la próxima década. El envejecimiento de la población, el aumento de la renta per cápita y un mayor gasto en asistencia sanitaria son factores que han contribuido a que China experimente tasas de crecimiento interanuales de hasta un 30 %.
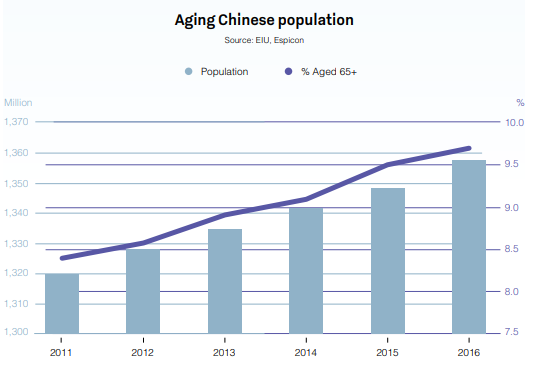
Fuente: Global Business Reports - China Pharmaceuticals 2018
Los cambios normativos están aligerando la carga de las empresas farmacéuticas internacionales que durante mucho tiempo han querido vender sus productos en este mercado prometedor, a la vez que ampliamente inexplorado. Los antiguos requisitos normativos chinos establecían que los ensayos clínicos realizados en China debían incluir pacientes chinos y pruebas realizadas en laboratorios locales, lo cual obligaba a las empresas farmacéuticas a realizar los ensayos de fase 3 totalmente independientes en China, y ello solo después de haber lanzado el producto en EE. UU. y la UE, para evitar poner en peligro la rapidez de comercialización en esos mercados.
Ahora, con estos cambios normativos (y con una población grande que no ha recibido tratamiento y apta para el reclutamiento para ensayos), los futuros ensayos se podrán llevar a cabo en China de forma simultánea a su lanzamiento en los EE. UU. y la UE. Esto supondrá una bendición para los pacientes chinos, que recibirán los medicamentos que necesiten más rápidamente, así como para las empresas farmacéuticas internacionales que sacan al mercado estos medicamentos.
En los próximos años, será interesante ver qué efecto (si lo hay) van a tener estos cambios sistémicos en la planificación del desarrollo clínico y las estrategias normativas de las empresas farmacéuticas que pretendan vender sus productos en China.
2. Los cambios normativos pueden reducir el número de ensayos clínicos redundantes y los riesgos innecesarios para los pacientes
Con esta incorporación al ICH, China aplica ya los estándares de buenas prácticas internacionales (p. ej., las buenas prácticas de fabricación o las buenas prácticas clínicas) ampliamente adoptados por la industria farmacéutica internacional. Esto también significa que los datos clínicos generados en China y en el extranjero en las regiones cubiertas por el ICH durante el desarrollo de medicamentos serán aceptados de manera bilateral por las autoridades reguladoras chinas e internacionales.
Estos cambios son importantes para armonizar los requisitos normativos y facilitar el desarrollo de medicamentos, pero también son fundamentales para evitar los ensayos clínicos redundantes o duplicados, que exponen a los pacientes a riesgos innecesarios. Las reformas dentro del sistema normativo chino coinciden con las reformas que estamos observando en los mercados mundiales: su objetivo es ofrecer a los ciudadanos un acceso mejor y más rápido a tratamientos nuevos e innovadores.
3. El volumen y el ritmo de los ensayos clínicos en China se disparará vertiginosamente
Una consecuencia de la reestructuración de la legislación china que parece indudable es que el volumen y el ritmo de los ensayos clínicos en China se va a disparar vertiginosamente en los próximos años. Las autoridades reguladoras chinas han realizado cambios que han permitido acelerar las revisiones reguladoras, implementar políticas nuevas y menos estrictas para la importación de medicamentos a China, conceder períodos de exclusividad en el mercado para productos específicos (p. ej., la supresión de los aranceles que gravan la importación de fármacos oncológicos) y realizar importantes mejoras en los plazos de aprobación de los ensayos clínicos en China.
Hasta ahora, se tardaba entre uno y tres años en obtener la aprobación de un ensayo clínico en China. Se prevé que ese plazo se reduzca sustancialmente (a 60 días hábiles). En principio, esto significa que los promotores de ensayos pueden presentar solicitudes y cumplir con los plazos tanto en la UE como en China, paralelamente.
Además, la NMPA está implementando revisiones prioritarias de determinados fármacos con el objetivo de acelerar su comercialización y facilitar que los pacientes puedan tener un acceso más rápido a fármacos que podrían salvar sus vidas (p. ej., para tratamientos innovadores, la tecnología más avanzada o tratamientos con importantes ventajas clínicas para algunas enfermedades, tales como VIH, tuberculosis, hepatitis, enfermedades raras, tumores malignos, o para uso pediátrico). Asimismo, la NMPA aceptará datos clínicos extranjeros para autorizar la comercialización de los productos.
Estos cambios impulsan el desarrollo y la comercialización de nuevos fármacos y abren un mundo de oportunidades a los fabricantes de medicamentos, a los promotores de ensayos y, lo que es más importante, a los pacientes.
Las empresas inteligentes, de todos los sectores, deberían mantener a China en su punto de mira. Los cambios normativos en la industria farmacéutica, que proporcionan una oportunidad sin precedentes, también suponen importantes retos para aquellas empresas farmacéuticas que desean realizar ensayos clínicos y comercializar fármacos en los mercados chinos de forma más rápida y eficaz.
Más ensayos y plazos más cortos equivalen a más contenido, más traducciones y una mayor necesidad de tener un socio experimentado con conocimientos especializados, alcance mundial y escalabilidad. Durante años, Lionbridge ha sido ese socio. Como siempre, estamos preparados para adentrarnos en nuevos territorios con usted, con el objetivo común de ofrecer medicamentos más seguros a más gente en más lugares y de forma más rápida. Póngase en contacto con nosotros para obtener más información sobre cómo podemos ayudarle a entrar en nuevos mercados, en China y en cualquier parte del mundo.
#china #contenido reglamentario #contenido regulado #ensayos clínicos #sector biomédico

