言語:
- サービス
- AI

- 業界

コンテンツ サービス
- 技術文書の作成
- トレーニングおよび eラーニング
- 財務報告書
- デジタル マーケティング
- SEO およびコンテンツの最適化
翻訳サービス
- 動画ローカリゼーション
- ソフトウェア ローカリゼーション
- Web サイト ローカリゼーション
- 規制対象企業向けの翻訳
- 通訳
- ライブ イベント
テスティング サービス
- 機能 QA およびテスト
- 互換性テスト
- 相互運用性テスト
- パフォーマンス テスト
- アクセシビリティ テスト
- UX/CX テスティング
ソリューション
- 翻訳サービス モデル
- 機械翻訳
- Smart Onboarding™
- Aurora AI Studio™
ライオンブリッジのナレッジ ハブ
- 良好な患者アウトカム
- ローカリゼーションの未来
- 最先端免疫学事情
- 新型コロナウイルス (COVID-19) 言語リソース センター
- ディスラプション シリーズ
- 患者エンゲージメント
- ライオンブリッジのインサイト
言語を選択する:
中国は、今や世界中のさまざまな業界において急成長中の大国であると言えます。
中国の人口は 2019 年の予測では 14 億 2 千万人となり、引き続き世界市場に大きな影響を与えることが予想されます。そのような市場の一つが製薬業です。
中国の医薬品市場は、同国での臨床研究と医薬品の発売を促進すべく、大幅な規制変更を行っています。中国の国立医薬品管理局 (NMPA) は ICH (医薬品規制調和国際会議) に参加しました。そのメンバーとなることで、中国は現在、国際的な製薬業界の慣行基準に従い、医薬品開発と臨床試験の実施について国際的な調和を進めています。
さらに、中国は最近、医薬品の開発と発売を促進する目的で規制の仕組みを再構築しました。
このような変化は、中国だけでなく世界的な成長の誘因となっています。
中国の医薬品市場の規制変更が世界にもたらす 3 つの影響を以下にご紹介します。
1.中国の医薬品市場の加速は、世界の製薬会社にとってチャンスをもたらす
5 兆 730 億ドルの規模で世界第 2 位の医薬品市場である中国は、2020 年代も成長を続けると予想されます。人口の高齢化、一人当たり所得の増加、医療費の増加に支えられ、中国は 前年比最大 30% の成長率を経験してきました。
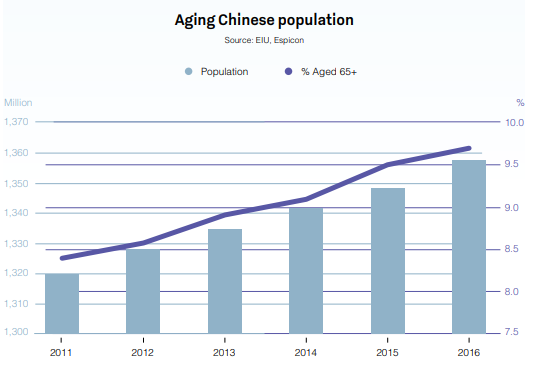
出所: Global Business Reports - China Pharmaceuticals 2018
この規制の変更は、この有望ながらも未開拓の市場で製品を販売したいと長年願ってきた世界的な製薬会社にとっては朗報と言えます。中国の長年の規制要件では、中国で実施される臨床試験には中国人の患者と現地の検査室での検査を含める必要がありました。このため、製薬会社はこれらの市場への参入スピードを危険にさらすことを避けるために、米国と EU で発売した後でのみ、中国で完全に独立した状態でフェーズ 3 の臨床試験を実施することを余儀なくされてきました。
現在、これらの規制の変更だけでなく、被験者に適した治療未経験の大規模な集団が存在する状況も伴って、今後の臨床試験が米国および EU での発売に合わせて中国で行われる可能性があります。これは、必要な薬をより迅速に入手したいと願う中国人患者と、これらの薬を市場に流通させたいと考えるグローバルな製薬会社の両方に恩恵をもたらすものと考えられます。
今後数年間で、これらの体系的な変更が、中国で製品を販売しようとする製薬会社の臨床開発計画と規制戦略にどのような影響を与えるかは興味深いところです。
2.規制の変更によって余分な臨床試験が減り、患者にとって不必要なリスクが少なくなる可能性がある
ICH のメンバーになったことで、中国は現在、世界の製薬業界で広く採用されている国際的な GxP 基準 (例: 適正製造基準 (GMP)、適正臨床実践 (GCP)) に準拠するようになりました。これはまた、医薬品開発中に中国および海外の ICH 地域で生成された臨床データが、中国および国際的な規制当局間で相互に受け入れられることも意味します。
この変化は、規制要件の調和と医薬品開発の促進に重要ですが、患者を不必要なリスクにさらす余分な、または重複した臨床試験を回避する上でも重要です。中国の規制システムにおける改革は、世界中の市場で見られる改革と一致しています。市民が新しい革新的な治療をより速く、より良い方法で手にできることを目指しています。
3.中国での臨床試験の量とペースは急増する
確実と思われる中国の規制再編の結果の一つとして、中国での臨床試験の量とペースが今後数年で急増することが挙げられます。中国の規制当局は、規制の見直しを促進し、中国への薬物輸入に関して新たに緩和された方針を実施し、特定の製品に対して市場の独占期間を保証する変更 (例: 輸入腫瘍薬の関税撤廃) を加え、中国での臨床試験の承認スケジュールを大幅に改善しています。
これまで、中国で臨床試験の承認を得るには 1〜3 年かかりました。この期間が 60 営業日にまで劇的に減少することが予想されます。原則として、これは、臨床試験の依頼者が申請書を提出し、EU と中国の両方で並行してスケジュールを実行できることを意味します。
さらに、NMPA は、市場参入までの時間を短縮し、命を救う薬への患者のより迅速なアクセスを促進することを目的として、特定の薬 (たとえば、革新的な治療、高度な技術、または HIV、結核、肝炎、希少疾患、悪性腫瘍、小児への使用など) の優先的なレビューを実施しています。NMPA は、市販認可のために外国の臨床データも新たに受け入れます。
これらの変更は新薬の開発とマーケティングを促進し、医薬品メーカー、臨床試験依頼者、そして最も重要なこととして、患者に機会の扉を開きます。
業界にかかわらず、賢明な企業であれば中国の動向には注目すべきです。この製薬業界の規制変更は、臨床試験を実施してより迅速かつ効率的に薬を中国市場に届けたいと願う製薬会社にとって前例のない大きな機会ではありますが、同時に大きな課題ももたらします。
臨床試験の回数が多く、期間が短いほど、より多くのコンテンツや翻訳が必要になるため、十分な実績と規模、そしてスケーラビリティを備えた優れたパートナーが不可欠になります。ライオンブリッジは、長年にわたって多くの世界的な製薬会社や医療関連のお客様のパートナーとして、迅速で効果的なグローバル展開をお手伝いしています。より安全な薬をより迅速に、より多くの地域、そして多くの人々にお届けすることを常に共通の目標として、当社はお客様とともに新たな市場にチャレンジする準備ができています。中国および世界中の新市場への参入を支援する当社のサービスについて、ぜひ当社までお問い合わせください。
#ライフ サイエンス #中国 #臨床試験 #規制コンテンツ