SPRACHE:
- WAS WIR TUN
- KI
Lionbridge Knowledge Hubs
- Positive Patientenergebnisse
- Die Zukunft der Lokalisierung

- BRANCHEN

Content-Services
- Technische Redaktion
- Schulungen
- Finanzberichte
- Digitales Marketing
- Content für SEO
Übersetzung und Lokalisierung
- Videolokalisierung
- Software-Lokalisierung
- Website-Lokalisierung
- Übersetzung für regulierte Branchen
- Dolmetschen
- Live Events
Testdienstleistungen
- Testservice
- Kompatibilitätsprüfungen
- Interoperabilitätsprüfungen
- Performance-Tests
- Zugänglichkeits-Tests
- Überprüfen des Kundenerlebnisses
Lösungen
- Übersetzungsservices
- Maschinelle Übersetzung
- Smart Onboarding™
- Aurora AI Studio™
Unsere Knowledge Hubs
- Positive Patientenergebnisse
- Die Zukunft der Lokalisierung
- Mit Innovation zur Immunität
- Covid-19-Sprachressourcen
- Disruption Series
- Patienteneinbindung
- Lionbridge Insights
- Pharma-Übersetzungen
- Klinisch
- Regulierung
- Nach der Zulassung
- Für Unternehmen
- Medizinprodukte-Übersetzungen
- Validierung/Klinische Studien
- Regulierung
- Nach der Autorisierung
- Für Unternehmen
Bank- und Finanzwesen
Einzelhandel
Luxusgüter
E-Commerce
Lionbridge Games
Automobilbranche
Konsumgüter
Technologie
Maschinenbau und Fertigung
Rechtsdienstleistungen
Tourismus und Gastgewerbe
SPRACHE AUSWÄHLEN:
Die chinesische Wirtschaftskraft ist weltweit in allen Branchen deutlich zu spüren.
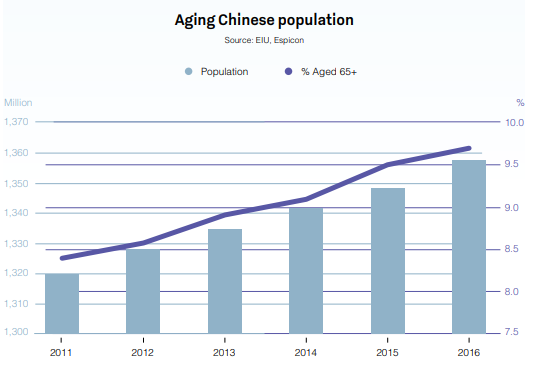
Mit einer geschätzten Bevölkerungszahl von 1,42 Milliarden im Jahr 2019 dürfte das Land die weltweiten Märkte noch auf viele Jahre hinaus nachhaltig beeinflussen. Einer dieser Märkte ist der Pharmasektor.
Der chinesische Arzneimittelmarkt erlebt derzeit größere regulatorische Änderungen, die Chancen für mehr klinische Forschung und Medikamenteneinführungen in China eröffnen könnten. Die chinesische Arzneimittelbehörde (National Medicinal Products Administration, NMPA) ist dem ICH (International Council for Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use) beigetreten. Mit dieser Mitgliedschaft befolgt China jetzt internationale Praxisstandards der Pharmabranche und trägt damit zur internationalen Harmonisierung der Entwicklung von Arzneimitteln und der Durchführung klinischer Studien bei.
Dazu kommt, dass China kürzlich sein Regulierungssystem umstrukturiert hat, um die Entwicklung und die Markteinführung von Arzneimitteln zu unterstützen und zu beschleunigen.
Diese Änderungen bewirken nicht nur in China, sondern weltweit einen Wachstumsschub.
Im Folgenden erläutern wir drei Implikationen der regulatorischen Änderungen auf dem chinesischen Arzneimittelmarkt für den Rest der Welt.
1. Die den chinesischen Arzneimittelmarkt beschleunigenden Regulierungsänderungen eröffnen Chancen für Pharmaunternehmen in aller Welt.
Mit einem Volumen von USD 573 Mrd. ist der chinesische Arzneimittelmarkt bereits jetzt der zweitgrößte der Welt und wird bis weit in die 2020er-Jahre hinein weiter wachsen. Infolge seiner großen und alternden Bevölkerung, des zunehmenden Pro-Kopf-Einkommens sowie der steigenden Gesundheitsausgaben verzeichnete China bislang jährliche Wachstumsraten von bis zu 30 %.
Die regulatorischen Änderungen schaffen jetzt Erleichterungen für weltweit tätige Pharmaunternehmen, die schon seit Langem ihre Produkte auf diesem vielversprechenden, aber noch weitgehend unerschlossenen Markt absetzen wollten. Laut den langjährigen chinesischen Bestimmungen mussten in China durchgeführte klinische Studien unter Beteiligung chinesischer Patienten in Laboratorien im Lande durchgeführt werden. Dadurch konnten Pharmaunternehmen umfassende eigenständige Phase-III-Studien in China erst nach der Produkteinführung in den USA und der EU durchführen, um ihre Markteinführungszeiten in diesen Regionen nicht zu gefährden.
Unter den neuen regulatorischen Bestimmungen – und mit einer großen Zahl bislang nicht therapierter potenzieller Probanden – können zukünftige Studien in China gleichzeitig mit den Produkteinführungen in den USA und der EU stattfinden. Dies ist ein unschätzbarer Vorteil für Patienten in China, die dringend benötigte Arzneimittel so schneller erhalten, aber auch für weltweit tätige Pharmaunternehmen, die diese Arzneimittel auf den Markt bringen.
In den kommenden Jahren wird es interessant sein, zu beobachten, ob und welche Auswirkungen diese Systemänderungen auf die Planung klinischer Entwicklungen und auf die regulatorischen Strategien von Pharmaunternehmen haben werden, die ihre Produkte in China absetzen wollen.
2. Regulatorische Änderungen können die Zahl redundanter klinischer Studien verringern und unnötige Risiken für Patienten vermeiden
Mit seiner Mitgliedschaft im ICH befolgt China jetzt internationale und in der weltweiten Pharmabranche weithin akzeptierte GxP-Standards (z. B. Good Manufacturing Practice (GMP, gute Herstellungspraxis) oder Good Clinical Practice (GCP, gute klinische Praxis). Dies bedeutet weiterhin, dass in China und den anderen ICH-Ländern im Rahmen der Arzneimittelentwicklung generierte klinische Daten von chinesischen und internationalen Zulassungsbehörden gleichermaßen akzeptiert werden.
Diese Änderungen sind wichtig für die Harmonisierung regulatorischer Anforderungen und die Förderung der Arzneimittelentwicklung. Sie sind aber auch von entscheidender Bedeutung, um redundante oder doppelte klinische Studien zu vermeiden, die Patienten unnötigen Risiken aussetzen. Die Reformen des chinesischen Regulierungssystems stehen im Einklang mit den Reformen, die wir auf den weltweiten Märkten sehen: Sie dienen dazu, den eigenen Bürgern schnelleren und besseren Zugang zu neuen und innovativen Therapien zu ermöglichen.
3. Umfang und Geschwindigkeit klinischer Studien in China werden rasant zunehmen
Ein Ergebnis der regulatorischen Umstrukturierungen in China scheint gewiss: Umfang und Geschwindigkeit klinischer Studien im Land werden in den kommenden Jahren rasant zunehmen. Die chinesischen Zulassungsbehörden haben Änderungen vorgenommen, die zulassungsrechtliche Prüfungen beschleunigen, neue, weniger restriktive Richtlinien für den Import von Arzneimitteln nach China vorsehen, Marktexklusivitätszeiträume für bestimmte Produkte garantieren (z. B. die Aufhebung von Zöllen auf importierte onkologische Medikamente) und die Genehmigungsfristen für klinische Studien in China erheblich verkürzen.
Bislang dauerte es ein bis drei Jahre, um die Genehmigung für eine klinische Studie in China zu erhalten. Dieses Zeitfenster dürfte sich massiv verkürzen – auf gerade einmal 60 Arbeitstage. Im Prinzip bedeutet dies, dass Sponsoren klinischer Studien ihre Anträge in China und der EU parallel einreichen und entsprechende Zeitpläne umsetzen können.
Darüber hinaus implementiert die NMPA prioritäre Prüfungen bestimmter Arzneimittel, um die Markteinführungszeit zu verkürzen und Patienten lebensrettende Medikamente schneller zugänglich zu machen (beispielsweise für innovative Therapien, moderne Technologien oder Therapien mit erheblichen klinischen Vorteilen für Erkrankungen wie HIV, Tuberkulose, Hepatitis, seltene Krankheiten, bösartige Tumore oder für die Kinderheilkunde). Die NMPA wird neu auch ausländische klinische Daten für die Genehmigung für das Inverkehrbringen akzeptieren.
Diese Änderungen erleichtern die Entwicklung und das Inverkehrbringen neuer Medikamente und bieten eine Fülle von neuen Möglichkeiten für Arzneimittelhersteller, Sponsoren klinischer Studien und – wichtiger noch – Patienten.
In allen Branchen täten vorausschauende Unternehmen gut daran, China im Auge behalten. Regulatorische Änderungen in der Pharmabranche, die bislang nicht da gewesene Chancen bieten, bringen auch große Herausforderungen für Pharmaunternehmen mit sich, die klinische Studien in China durchführen und ihre Arzneimittel schneller und effizienter auf den chinesischen Markt bringen möchten.
Mehr klinische Studien und kürzere Fristen bedeuten mehr Inhalte, mehr Übersetzungen und eine größere Nachfrage nach bewährten, erfahrenen Partnern mit globaler Reichweite und Skalierbarkeit. Lionbridge ist seit vielen Jahren ein solcher Partner. Wie immer sind wir bereit, zusammen mit Ihnen Neuland zu erkunden – mit dem gemeinsamen Ziel, mehr Menschen an mehr Orten in kürzerer Zeit mit sichereren Arzneimitteln zu versorgen. Wenden Sie sich an uns, um mehr darüber zu erfahren, wie wir Ihnen helfen können, auf neue Märkte vorzudringen – in China und in aller Welt.