LANGUE :
- CE QUE NOUS FAISONS
- IA
Pôles de connaissances Lionbridge
- Résultats positifs pour les patients

- SECTEURS

Services de contenu
- Rédaction technique
- Formation et eLearning
- Reporting financier
- Marketing numérique
- Optimisation de contenu
Services de traduction
- Localisation vidéo
- Localisation de logiciels
- Localisation de site Web
- Traduction certifiée
- Interprétation
- Événements en direct
Services de tests
- Assurance qualité fonctionnelle et tests
- Tests de compatibilité
- Tests d'interopérabilité
- Test des performances
- Tests d'accessibilité
- Test utilisateur/client
Solutions
- Modèles de services de traduction
- Traduction automatique
- Smart Onboarding™
- Aurora AI Studio™
Nos pôles de connaissances
- Résultats positifs pour les patients
- Futur de la localisation
- De l'innovation à l'immunité
- Centre de ressources pour la COVID-19
- Série Disruptive
- Engagement patient
- Lionbridge Perspectives
Sciences de la vie
- Pharmaceutique
- Clinique
- Réglementaire
- Post-approbation
- Entreprise
- Dispositifs médicaux
- Validation et clinique
- Réglementaire
- Post-autorisation
- Entreprise
Banque et finance
Vente au détail
Luxe
E-commerce
Lionbridge Games
Automobile
Biens de Consommation
Technologie
Fabrication industrielle
Services juridiques
Tourisme
SÉLECTIONNER LA LANGUE :
La Chine est une puissance en plein essor dans tous les secteurs mondiaux.
Avec une population qui devrait atteindre 1,42 milliard d'habitants en 2019, ce pays devrait continuer à bouleverser les marchés mondiaux pendant longtemps encore. Voici un exemple de marché concerné : l'industrie pharmaceutique.
Le marché chinois des médicaments connaît d'importants changements réglementaires qui pourraient permettre d'augmenter le nombre de recherches cliniques et de lancements de médicaments en Chine. La National Medicinal Products Administration (NMPA) chinoise a rejoint le CIH (Conseil international d'harmonisation des exigences techniques pour l'enregistrement des médicaments à usage humain). Du fait de cette adhésion, la Chine applique désormais les normes de l'industrie pharmaceutique internationale, ce qui permet d'améliorer l'harmonisation à l'échelle internationale des processus de développement de médicaments et de l'exécution des essais cliniques.
En outre, la Chine a récemment restructuré son système réglementaire, l'objectif étant de favoriser et d'accélérer les processus de développement et de distribution de médicaments.
Ces évolutions sont des catalyseurs de croissance non seulement en Chine, mais également dans le monde entier.
Voici trois implications pour le monde des évolutions réglementaires du marché chinois des médicaments.
1. L'accélération du marché pharmaceutique chinois offre des opportunités pour les entreprises pharmaceutiques internationales
La Chine est déjà le deuxième plus grand marché pharmaceutique au monde avec une valeur de 573 milliards de dollars, et cette croissance va se poursuivre en 2020. Grâce à sa population importante et vieillissante, à la croissance de son revenu par habitant et à l'augmentation des dépenses de santé, la Chine a enregistré des taux de croissance sur 12 mois supérieurs à 30 %.
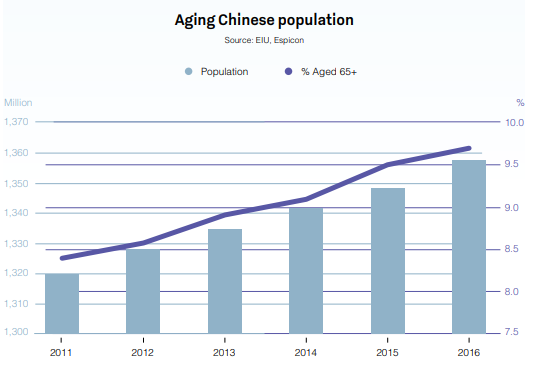
Source : Global Business Reports - China Pharmaceuticals 2018
Les changements réglementaires contribuent aujourd'hui à réduire le fardeau des entreprises pharmaceutiques internationales qui souhaitaient depuis longtemps vendre leurs produits sur ce marché prometteur mais largement inexploité. Les anciennes exigences réglementaires chinoises stipulaient que les essais cliniques réalisés en Chine devaient inclure des patients chinois et des tests dans des laboratoires locaux, ce qui contraignait les entreprises pharmaceutiques à effectuer des essais de phase trois autonomes et complets en Chine uniquement après avoir lancé le produit aux États-Unis et en Europe afin d'éviter de compromettre les délais de commercialisation sur ces marchés.
Aujourd'hui, du fait de ces changements réglementaires, et grâce à une population importante qui n'a jamais reçu de traitement, ce qui en fait le choix idéal pour le recrutement des participants aux essais, les futurs essais pourront être réalisés en Chine parallèlement aux lancements aux États-Unis et dans l'UE. Cela profitera à la fois aux patients chinois, qui recevront plus rapidement les médicaments dont ils ont besoin, et aux entreprises pharmaceutiques internationales qui commercialisent ces médicaments.
Au cours des prochaines années, il sera intéressant de voir quels effets, le cas échéant, ces changements systémiques auront sur la planification du développement clinique et les stratégies réglementaires des entreprises pharmaceutiques qui souhaitent commercialiser leurs produits en Chine.
2. Les changements réglementaires pourront avoir pour effet de réduire le nombre d'essais cliniques redondants et les risques inutiles pour les patients
Suite à son adhésion au CIH, la Chine applique désormais les normes GxP internationales (par ex. les normes GMP - Good Manufacturing Practice - ou GCP - Good Clinical Practice), qui sont largement adoptées par l'industrie pharmaceutique internationale. Cela signifie également que les données cliniques générées en Chine et à l'étranger sur les territoires couverts par le CIH pendant le processus de développement des médicaments seront acceptées de façon bilatérale par les autorités réglementaires chinoises et internationales.
Ces changements sont importants pour l'harmonisation des exigences réglementaires et la simplification du processus de développement des médicaments, mais ils sont également essentiels pour éviter les essais cliniques redondants ou dupliqués, qui exposent les patients à des risques inutiles. Ces réformes du système réglementaire chinois sont en phase avec celles que nous pouvons observer sur les marchés internationaux : elles ont pour objet d'offrir aux citoyens un accès plus rapide et plus aisé à de nouveaux traitements innovants.
3. Le nombre d'essais cliniques réalisés en Chine va augmenter de façon abrupte, et leur rythme va radicalement s'accélérer
Il est quasiment certain que cette restructuration réglementaire engagée en Chine aura pour résultat d'augmenter de façon abrupte le nombre d'essais cliniques réalisés en Chine et d'accélérer radicalement leur rythme au cours des prochaines années. Les changements apportés par les autorités réglementaires chinoises permettent d'accélérer les examens réglementaires, de mettre en œuvre de nouvelles politiques moins strictes pour l'importation de médicaments en Chine, d'accorder des périodes d'exclusivité commerciale garantie pour certains produits spécifiques (par exemple en supprimant les tarifs douaniers sur les médicaments oncologiques importés) et d'améliorer de façon significative les délais d'approbation des essais cliniques en Chine.
Jusqu'à aujourd'hui, il fallait entre un et trois ans pour obtenir l'autorisation de réaliser un essai clinique en Chine. Ce délai devrait être considérablement réduit pour passer à 60 jours ouvrés. En principe, cela signifie que les promoteurs d'essais cliniques peuvent envoyer des demandes d'autorisation et se conformer aux délais à la fois dans l'UE et en Chine, en parallèle.
En outre, la NMPA met en place des examens prioritaires pour certains médicaments, l'objectif étant d'accélérer la mise sur le marché et de permettre aux patients d'accéder plus facilement et plus rapidement à des médicaments d'importance vitale (par exemple les traitements innovants, les technologies avancées ou les traitements apportant des avantages cliniques significatifs pour certaines maladies comme le VIH, la tuberculose, l'hépatite, les maladies rares et les tumeurs malignes, ou encore les traitements destinés à un usage pédiatrique). Autre nouveauté, la NMPA acceptera également les données cliniques étrangères pour l'autorisation de mise sur le marché.
Ces changements encouragent le développement et la commercialisation de nouveaux médicaments, offrant ainsi une myriade de possibilités pour les fabricants de médicaments, pour les promoteurs d'essais et, surtout, pour les patients.
Quel que soit le secteur, les entreprises intelligentes seraient bien avisées de garder un œil sur la Chine. Ces changements réglementaires dans l'industrie pharmaceutique, qui représentent une opportunité unique, entraînent également des défis considérables pour les entreprises pharmaceutiques qui souhaitent réaliser des essais cliniques et distribuer des médicaments sur les marchés chinois de façon plus rapide et plus efficace.
L'augmentation du nombre d'essais cliniques et les délais plus courts vont entraîner une augmentation des volumes de contenus et de traductions, ce qui signifie que vous aurez plus que jamais besoin d'un partenaire chevronné possédant l'expérience, la présence mondiale et l'évolutivité nécessaires. Depuis des années, Lionbridge est ce partenaire. Comme toujours, nous sommes prêts à vous accompagner dans ce territoire inconnu, dans l'objectif commun de distribuer des médicaments plus sûrs à davantage de personnes, dans plus de pays et plus rapidement. Contactez-nous pour découvrir comment nous pouvons vous aider à pénétrer sur de nouveaux marchés, en Chine et à travers le monde.
#chine #contenus réglementaires #contenus réglementés #essais cliniques #sciences de la vie