- SERVIZI OFFERTI

Webinar
Dentro la strategia dell'AI: come usarla, come farne un punto di forza e come ottimizzare i risultati.

- Settori

- RISORSE
Hub di conoscenze Lionbridge
Risultati positivi per i pazienti

Framework TRUST di Lionbridge
Rafforzare la fiducia nell'uso dell'intelligenza artificiale

- CHI SIAMO

Collaboratori internazionali: Lex Parisi
Director of Gaming Marketing Solutions di Lionbridge Games

Home Servizi offerti
Intelligenza artificiale generativa
- Servizi di Traduzione IA
- Content Remix
Servizi di dati basati sull'AI
- Aurora AI Studio™
Traduzione automatica
- MT Tracker
Onboarding dei clienti
Modelli di servizi di traduzione
Servizi per i contenuti
- Redazione di testi tecnici
- Formazione e eLearning
- Report finanziari
- Marketing digitale
- SEO e ottimizzazione dei contenuti
Servizi di traduzione
- Localizzazione di video
- Localizzazione di software
- Localizzazione di siti web
- Traduzione di contenuti regolamentati
- Interpretariato
- Eventi live
- Language Quality Services
Servizi di test
- Test funzionali per il controllo della qualità
- Test di compatibilità
- Test di interoperabilità
- Test delle prestazioni
- Test di accessibilità
- UX/CX Testing
Home Settori
Traduzioni Life Science
- Traduzioni farmaceutiche
- Traduzioni di trial clinici
- Traduzioni normative
- Traduzioni post-approvazione
- Traduzioni farmaceutiche aziendali
- Servizi linguistici per dispositivi medici
- Convalida e contenuti clinici
- Traduzioni normative
- Traduzioni post-autorizzazione
- Traduzioni per dispositivi medici aziendali
Bancario e finanziario
Retail
Lusso
E-Commerce
Lionbridge Games
Automotive
Beni di largo consumo
Tecnologico
Produzione industriale
Servizi in ambito legale
Viaggi e turismo
Approfondimenti
- Post di blog
- Case study
- White paper
- Solution brief
- Infografiche
- eBook
- Video
Webinar
Hub di conoscenze Lionbridge
- Risultati positivi per i pazienti
- Soluzioni per i moderni trial clinici
- Interazione con i pazienti
- Leadership di pensiero nell'AI
SELEZIONATE LA LINGUA:
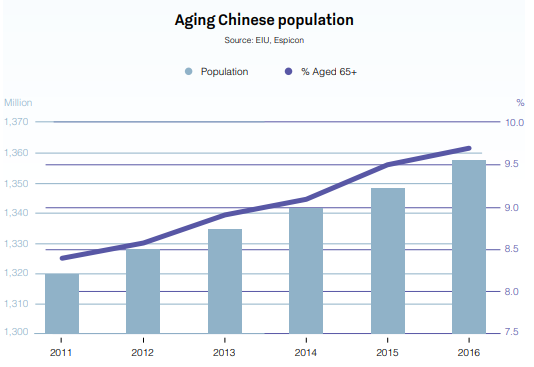
In molti settori internazionali l'importanza della Cina è in rapida crescita.
Questo Paese, la cui popolazione nel 2019 si prevede raggiungerà 1,42 miliardi, avrà una grossa influenza sui mercati internazionali in futuro. Uno dei mercati interessati? Il settore farmaceutico.
Nel mercato cinese dei farmaci sono in corso cambiamenti significativi delle normative, volti ad agevolare le ricerche cliniche e la produzione di nuovi farmaci in Cina. La National Medicinal Products Administration (NMPA) cinese è entrata a far parte dell'ICH (International Council for Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use, Conferenza internazionale per l'armonizzazione dei requisiti tecnici per la registrazione dei farmaci ad uso umano). Grazie a questa adesione, la Cina ora segue le prassi standard del settore farmaceutico internazionale, con una conseguente maggiore armonizzazione, a livello mondiale, dello sviluppo di farmaci e dell'esecuzione di trial clinici.
La Cina ha inoltre ristrutturato di recente il proprio sistema normativo, con l'obiettivo di incoraggiare e accelerare lo sviluppo e la produzione di farmaci.
Questi cambiamenti favoriscono la crescita, non solo in Cina ma in tutto il mondo.
Ecco tre implicazioni a livello mondiale delle modifiche alle normative del mercato farmaceutico cinese.
1. L'accelerazione del mercato farmaceutico cinese offre opportunità per le case farmaceutiche internazionali
La Cina è già il secondo mercato farmaceutico più grande del mondo, con un giro d'affari di 573 miliardi di dollari, destinato a crescere ancora in questo decennio. Con una popolazione vasta e sempre più longeva, un reddito pro capite in continuo aumento e spese sempre più alte nel settore sanitario, la Cina ha registrato un tasso di crescita su base annua che ha raggiunto il 30%.
Le modifiche alle normative alleggeriscono ora gli oneri per le case farmaceutiche internazionali che da tempo puntano a vendere i propri prodotti in questo mercato promettente ma ancora poco sfruttato. I requisiti normativi cinesi in passato richiedevano che i trial clinici condotti in Cina includessero pazienti cinesi e test in laboratori locali, obbligando così le case farmaceutiche a condurre trial completi autonomi di fase 3 in Cina solo dopo il lancio negli Stati Uniti e nell'Unione Europea, per evitare di mettere a repentaglio la velocità di introduzione su questi mercati.
Ora, con i cambiamenti delle normative e con una vasta popolazione di pazienti non ancora curati e idonei per i trial, i futuri trial potranno essere svolti in Cina in concomitanza con i lanci negli Stati Uniti e nell'Unione Europea. Ciò andrà a vantaggio sia dei pazienti cinesi, che riceveranno i farmaci necessari più rapidamente, sia delle case farmaceutiche internazionali che introducono questi farmaci sul mercato.
In futuro sarà interessante osservare gli effetti di questi cambiamenti sistematici sulla pianificazione dello sviluppo clinico e sulle strategie di regolamentazione delle case farmaceutiche che puntano a vendere i propri prodotti in Cina.
2. Le modifiche alle normative comportano una riduzione dei trial clinici ridondanti e meno rischi non necessari per i pazienti
Grazie alla sua adesione all'ICH, la Cina ora segue le prassi standard GxP internazionali, ad esempio le norme di buona fabbricazione (GMP, Good Manufacturing Practice) o le buone pratiche cliniche (GCP, Good Clinical Practice) ampiamente adottate nel settore farmaceutico mondiale. Ciò significa anche che i dati clinici generati in Cina e all'estero nei territori aderenti all'ICH saranno accettati bilateralmente dalle autorità di regolamentazione cinesi e internazionali.
Questi cambiamenti sono importanti per l'armonizzazione dei requisiti normativi e l'agevolazione dello sviluppo dei farmaci, ma sono anche fondamentali per evitare trial clinici ridondanti o duplicati, che espongono i pazienti a rischi non necessari. Le riforme nel sistema normativo cinese riflettono la tendenza dei mercati internazionali: lo scopo è quello di fornire ai cittadini un accesso più rapido e migliore a terapie nuove e innovative.
3. Il volume e le tempistiche dei trial clinici in Cina miglioreranno considerevolmente
Un risultato della riorganizzazione delle normative cinesi che sembra essere certo è un considerevole miglioramento, nei prossimi anni, del volume e delle tempistiche dei trial clinici in Cina. Le autorità di regolamentazione cinesi hanno introdotto modifiche che accelerano le revisioni normative, implementano nuove e meno rigorose politiche per l'importazione di farmaci in Cina, concedono periodi di esclusiva di mercato garantiti per prodotti specifici (ad esempio con la rimozione dei dazi doganali sui farmaci oncologici importati) e apportano miglioramenti significativi alle tempistiche di approvazione dei trial clinici in Cina.
Fino a oggi, l'approvazione dei trial clinici in Cina ha richiesto da uno a tre anni. Si prevede che questo lasso di tempo sia ora destinato a ridursi notevolmente, fino a raggiungere i sessanta giorni lavorativi. In linea di principio, ciò significa che gli sponsor dei trial avranno la possibilità di presentare le domande e svolgere i passaggi in Unione Europea e in Cina contemporaneamente.
La NMPA sta inoltre implementando cicli di revisione prioritari per determinati farmaci, con l'obiettivo di accelerare i tempi di immissione sul mercato e agevolare l'accesso dei pazienti ai farmaci salvavita (ad esempio per terapie innovative, tecnologia avanzata o trattamenti con vantaggi clinici significativi per malattie come HIV, tubercolosi, epatite, malattie rare, tumori maligni o uso pediatrico). La NMPA accetterà inoltre i dati clinici esteri per l'autorizzazione all'immissione sul mercato.
Questi cambiamenti incoraggiano lo sviluppo di nuovi farmaci e la loro commercializzazione, aprendo infinite nuove opportunità per le case farmaceutiche, gli sponsor dei trial e, ancora più importate, i pazienti.
Le aziende più avvedute faranno bene a tenere d'occhio la Cina in diversi settori. Le modifiche alle normative del settore farmaceutico che offrono opportunità senza precedenti comportano anche sfide significative per le case farmaceutiche che puntano a svolgere trial clinici in Cina e immettere i farmaci sul mercato cinese in modo più rapido ed efficiente.
Un aumento dei trial e una riduzione delle tempistiche significano più contenuti, più traduzioni e una maggior necessità di un partner esperto con competenze, portata internazionale e capacità di scalabilità. Lionbridge è da anni un partner capace di rispondere a questi requisiti. Come sempre, siamo pronti a conquistare con voi un territorio inesplorato, con l'obiettivo di fornire medicinali più sicuri a più persone e in più luoghi in tempi più rapidi. Contattateci per saperne di più su come vi accompagneremo alla conquista di nuovi mercati, in Cina e nel resto del mondo.