LANGUE :
- CE QUE NOUS FAISONS
- IA
Pôles de connaissances Lionbridge
- Résultats positifs pour les patients

- SECTEURS

Services de contenu
- Rédaction technique
- Formation et eLearning
- Reporting financier
- Marketing numérique
- Optimisation de contenu
Services de traduction
- Localisation vidéo
- Localisation de logiciels
- Localisation de site Web
- Traduction certifiée
- Interprétation
- Événements en direct
Services de tests
- Assurance qualité fonctionnelle et tests
- Tests de compatibilité
- Tests d'interopérabilité
- Test des performances
- Tests d'accessibilité
- Test utilisateur/client
Solutions
- Modèles de services de traduction
- Traduction automatique
- Smart Onboarding™
- Aurora AI Studio™
Nos pôles de connaissances
- Résultats positifs pour les patients
- Futur de la localisation
- De l'innovation à l'immunité
- Centre de ressources pour la COVID-19
- Série Disruptive
- Engagement patient
- Lionbridge Perspectives
Sciences de la vie
- Pharmaceutique
- Clinique
- Réglementaire
- Post-approbation
- Entreprise
- Dispositifs médicaux
- Validation et clinique
- Réglementaire
- Post-autorisation
- Entreprise
Banque et finance
Vente au détail
Luxe
E-commerce
Lionbridge Games
Automobile
Biens de Consommation
Technologie
Fabrication industrielle
Services juridiques
Tourisme
SÉLECTIONNER LA LANGUE :
Dans le cadre de notre dernière série sur la COVID-19, des experts de Lionbridge proposent des axes de réflexion sur l'écosystème du développement clinique et des autorisations des organismes de réglementation durant la pandémie et à l'avenir.
Grâce à son envergure, à son excellence dans le domaine des services et à sa gamme de solutions linguistiques, de communication et technologiques, Lionbridge est bien positionné pour soutenir toute accélération des efforts de mise sur le marché de vaccins et de traitements pouvant sauver des vies.
Les statistiques mentionnées dans le présent article ont été mises à jour lundi 7 décembre 2020.
La course au vaccin contre la COVID-19
Ne traînez pas si vous souhaitez rester au fait des avancées concernant le développement d'un vaccin contre le virus COVID-19. Le développement de candidats-vaccins progresse à une vitesse sans précédent, faisant ainsi passer la procédure standard de développement de nouveaux traitements pour une simple promenade de santé. Avec un bilan humain de plus en plus lourd, cette course au vaccin nécessite une mobilisation de tous les acteurs du secteur de la santé sur le plan international. À ce jour, on recense à l'échelle mondiale plus de 1,5 millions de décès et 66 millions de cas confirmés dus à la pandémie, et les chiffres continuent de grimper, selon l'OMS.
On dénombre à l'heure actuelle 1 157 essais cliniques en cours dans le monde concernant l'infection par le SARS-CoV et au moins 100 vaccins en développement. Le 20 novembre, Pfizer et BioNTech ont annoncé qu'ils allaient déposer une demande d'autorisation d'utilisation d'urgence (AUU) à la FDA pour leur candidat vaccin BNT162b2. Le 25 novembre, la société Moderna a annoncé qu'elle avait conclu une convention d'achat préalable avec la Commission européenne pour 80 millions de doses de leur candidat vaccin mRNA-1273.
Parmi les autres candidats au dernier stade de développement : le vaccin AstraZeneca, plus connu sous le nom d'AZD1222 et développé en partenariat avec l'université Oxford, et le vaccin recombinant Ad5-nCoV, mis au point par la société chinoise CanSino Biologics.

Accélération du développement et maintien de la qualité
Un sentiment d'urgence et un changement radical sont généralement les mécanismes de réponse les plus efficaces pour lutter contre une nouvelle menace, et il en va assurément de même pour cette pandémie. L'excellence opérationnelle et la conduite d'essais virtuels ont joué un rôle essentiel dans le développement de nouveaux vaccins contre la COVID-19, et la nature urgente ainsi que la gravité de la pandémie ne permettent aucun compromis en matière de qualité.
Les autorités de régulation du monde entier proposent des procédures accélérées pour les avis scientifiques et l'autorisation d'utilisation d'urgence. Dans le même temps, elles ont également mis l'accent sur la quantité et la qualité des données expérimentales nécessaires pour obtenir le feu vert réglementaire.
Les directives de la FDA publiées au mois d'octobre concernant l'autorisation d'utilisation d'urgence de vaccins pour prévenir la COVID-19 abordent de front la question de la qualité. L'agence délivrera une AUU seulement si elle parvient à déterminer que « les avantages du vaccin compensent ses risques, sur la base de données provenant d'au moins un essai de phase 3 correctement mené et permettant de démontrer l'efficacité et la fiabilité du vaccin de manière claire et convaincante ».
Un équilibre constant entre sécurité, efficacité et qualité
Dans l'environnement actuel de développement de vaccins contre la COVID-19, des essais de phase 3 de grande ampleur recrutent jusqu'à 40 000 participants sur plusieurs centaines de sites et se déroulent à une vitesse impressionnante. L'essai de sécurité et d'efficacité de phase 2/3 de Pfizer pour leur candidat vaccin (BNT162b2) a été initié seulement trois mois après le début de leurs essais cliniques de phase 1/2 destinés à vérifier l'innocuité et l'immunogénicité du vaccin. Seulement deux heures après avoir reçu le feu vert de la FDA, Pfizer a administré la première dose de vaccin au premier participant à l'essai.
En Russie, depuis le 23 novembre, deux vaccins avaient déjà été approuvés. Toutefois, ces deux vaccins ont été approuvés par le ministère russe de la Santé avant même l'initiation de la phase 3. L'annonce faite en août par Vladimir Poutine a été reçue avec beaucoup d'inquiétude par les experts, qui ont qualifié cette accélération du processus réglementaire d'une « stupidité sans nom » et de « vraiment inquiétante et extrêmement risquée ».
Le développement des médicaments repose sur un équilibre constant entre sécurité, efficacité et qualité, et la course au vaccin doit allier rapidité ainsi que fiabilité et intégrité des données.
De la concurrence à la collaboration : une course contre la montre
Pendant la pandémie, les acteurs du secteur qui se font habituellement concurrence pour la commercialisation de nouveaux traitements innovants ont fait preuve d'un effort de collaboration hors du commun. Les technologies propriétaires et l'expertise (normalement lourdement protégées au sein du secteur pharmacologique) sont désormais mises en commun pour accélérer le développement d'un vaccin contre la COVID-19.
Parmi ces partenariats, la collaboration entre GSK et Sanofi, deux des principaux fabricants de vaccins au monde et rivaux de longue date. GSK a accordé à Sanofi l'accès à son expertise en matière d'adjuvants qui, conjuguée au candidat vaccin de Sanofi, pourrait permettre de renforcer la réponse immunitaire au vaccin et de réduire la quantité nécessaire de vaccin par dose. Cette avancée sera essentielle compte tenu de l'ampleur de la pandémie et de l'engagement des deux partenaires envers le gouvernement américain de fournir jusqu'à 100 millions de doses.
Collaboration : mise en œuvre simultanée des phases
Une telle rapidité de développement n'a jamais été observée.
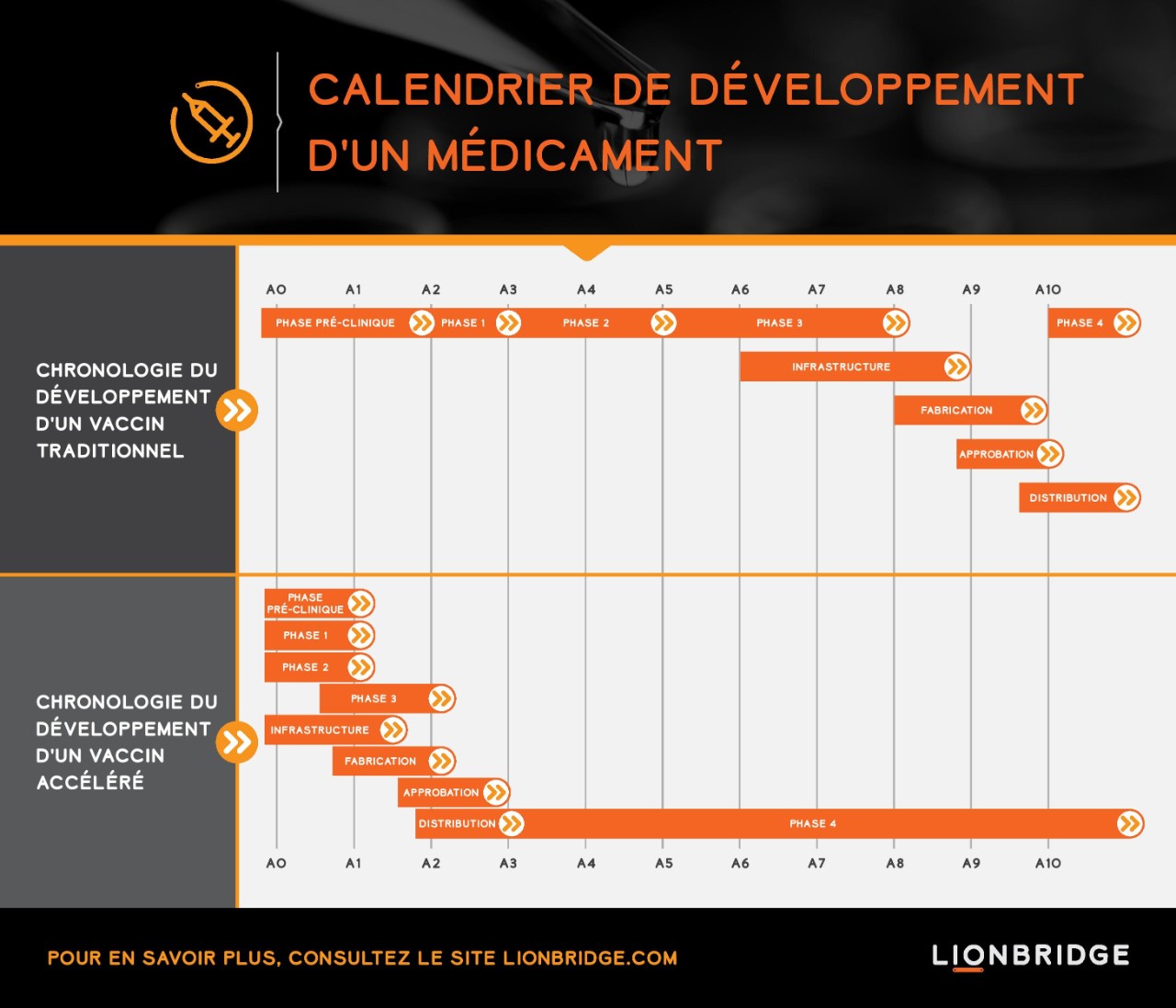
Le développement d'un vaccin prend généralement plus d'une décennie, de la découverte à l'homologation par les organismes de régulation, en passant par le programme de développement clinique qui se déroule en phases successives. Le processus de développement accéléré que nous observons actuellement pour les vaccins contre la COVID-19 évolue selon un mode d'exécution simultané. Des essais combinant la phase 1/2 et la phase 2/3 sont mis en œuvre en parallèle en vue d'accélérer le développement de vaccins. Les essais prévoient diverses évaluations de résultats, des échantillons hétérogènes et davantage de candidats vaccins.
À titre d'exemple, Pfizer a testé quatre candidats en parallèle dans le cadre de son essai de phase 1/2 avant de sélectionner son principal candidat pour la phase 2/3 (BNT162b2). L'essai clinique de phase 2/3 consacré au BNT162b2 a inclus environ 44 000 participants sur 155 sites d'essai aux États-Unis, en Argentine, au Brésil, en Allemagne, en Afrique du Sud et en Turquie. L'ampleur de cet essai est non seulement considérable en termes de nombre de participants et de sites, mais également en raison de la diversité des participants. L'essai a été lancé en recrutant des adultes appartenant à trois groupes d'âge différents, jusqu'à 85 ans, puis a ensuite été élargi pour inclure des adolescents âgés de 12 ans et plus. En outre, le vaccin a été testé chez des personnes atteintes du VIH et de l'hépatite B ou C chroniques. Pfizer et BioNTech, co-inventeurs du vaccin, prévoient de produire jusqu'à 50 millions de doses en 2020 et 1,3 milliard de doses d'ici fin 2021.
Les conséquences de la COVID-19 sur le futur modèle de service
La pandémie de COVID-19 a prouvé qu'il était possible de réduire à deux ans seulement le délai de développement standard de huit ans entre la phase préclinique et la fin de la phase 3 et de mettre un vaccin sur le marché en trois ans seulement. Une telle rapidité de développement n'a jamais été observée. C'est la raison pour laquelle nous espérons à présent que des vaccins seront commercialisés d'ici la fin de l'année.

Cet effort international sans précédent des acteurs du secteur, des organismes de réglementation, des administrations et des organismes de santé va-t-il inciter à accélérer le développement de thérapies essentielles ou rares pour lesquelles il n'existe aujourd'hui aucun traitement ? Pourquoi ces patients ne pourraient-ils pas bénéficier de l'excellence opérationnelle que nous avons constatée dans le cadre de la pandémie ? La pandémie a non seulement démontré que le développement et la production peuvent être réduits de plusieurs années, mais elle a également encouragé l'utilisation d'infrastructures et d'outils numériques tels que les agendas électroniques, la télémédecine, les smartphones et les articles vestimentaires qui ont contribué à accélérer l'exécution des essais cliniques.
Cette accélération de l'exécution aura un impact sur l'ensemble de la chaîne d'approvisionnement et sur les prestataires de services qui devront opérer avec une rapidité et une souplesse accrues afin de répondre aux exigences du secteur et des autorités réglementaires. Pour un prestataire de services linguistiques, l'accélération des études cliniques et des autorisations de mise sur le marché aura un impact sur le modèle de service et exigera des performances exceptionnelles en termes de prestation, d'allocation de ressources et de capacité linguistique. Les ressources linguistiques, l'automatisation et l'évolutivité seront autant de facteurs nécessaires pour proposer des services accélérés, de même qu'une assurance qualité linguistique scrupuleuse pour la gestion des risques.