言語:
- サービス
- AI

- 業界

コンテンツ サービス
- 技術文書の作成
- トレーニングおよび eラーニング
- 財務報告書
- デジタル マーケティング
- SEO およびコンテンツの最適化
翻訳サービス
- 動画ローカリゼーション
- ソフトウェア ローカリゼーション
- Web サイト ローカリゼーション
- 規制対象企業向けの翻訳
- 通訳
- ライブ イベント
テスティング サービス
- 機能 QA およびテスト
- 互換性テスト
- 相互運用性テスト
- パフォーマンス テスト
- アクセシビリティ テスト
- UX/CX テスティング
ソリューション
- 翻訳サービス モデル
- 機械翻訳
- Smart Onboarding™
- Aurora AI Studio™
ライオンブリッジのナレッジ ハブ
- 良好な患者アウトカム
- ローカリゼーションの未来
- 最先端免疫学事情
- 新型コロナウイルス (COVID-19) 言語リソース センター
- ディスラプション シリーズ
- 患者エンゲージメント
- ライオンブリッジのインサイト
言語を選択する:
新型コロナウイルス関連の最新シリーズでは、当社ライオンブリッジの専門家が感染拡大期からその後にかけての臨床開発や、規制承認の構造的な変化についての見解を述べます。
事業規模、多言語に対応する高度なサービス、コミュニケーションや技術面をサポートするソリューションをさまざまな業界のお客様に提供してきたライオンブリッジでは、スピードが求められる新型コロナウイルスのワクチンや救命治療の実用化を実現する上でもさまざまなサポートを提供しています。
本記事では 2020 年 12 月 7 日現在のデータを使用しています。
新型コロナウイルス ワクチン開発競争
新型コロナウイルスのワクチン開発に参入するのであれば「スピード」がカギとなります。ワクチン候補の開発は過去に類を見ないスピードで進展しており、通常の新規治療法の開発プロセスと比べると、全力疾走するランナーとのんびり散歩している歩行者ほどの違いがあります。ここまでのスピードに達したのは、死傷者数の増加に伴って、世界中のすべての医療インフラ従事者に対応が求められていることが主な要因です。WHO によると、今回のパンデミックで新型コロナウイルスの感染が確認された患者数は 6,600 万人、死亡者数は 150 万人を超え、その数はさらに増加しています。
開発競争は現時点で、SARS コロナウイルス感染症に対応するグローバルな臨床パイプラインで 1,157 件の臨床試験が実施され、少なくとも 100 種類のワクチンが開発中です。11 月 20 日には、ファイザーと BioNTech が共同開発したワクチン候補 BNT162b2 の緊急使用許可 (EUA) を FDA に申請したことを発表し、11 月 25 日にはモデルナが、欧州委員会がワクチン候補 mRNA-1273 の 8,000 万回分の追加購入契約を承認したと発表しました。
アストラゼネカがオックスフォード大学と共同で開発した AZD1222 ワクチン、中国に拠点を持つカンシノ バイオロジクスが開発した遺伝子組み換え型ワクチン Ad5-nCoV など、その他のワクチン候補も臨床試験パイプラインの終盤に差しかかっています。

品質を妥協せず開発の迅速化を図る
緊急時対応では時間的な制約や大幅な変更を意識した対応が功を奏するものですが、今回のパンデミックも例外ではありません。綿密なスケジュール管理やバーチャル臨床試験が新型コロナウイルスの新規ワクチン開発に寄与しましたが、深刻な感染拡大が急速に進む中でも、品質を妥協するわけにはいきません。
世界各地の規制当局は、科学的助言や緊急使用許可に要する日数を短縮する措置を講じる一方で、調査に要するデータが質と量の両方で認可基準を満たすことも変わらず重視しています。
FDA が 10 月に発表した新型コロナウイルス予防ワクチンの緊急使用許可に関するガイドラインでは、品質に関する疑問を優先的に取り上げています。緊急使用許可は「ワクチンの有効性と安全性が明確かつ説得力のある形で例証され、十分に検討されたフェーズ 3 臨床試験の少なくとも 1 回のデータを基に、ワクチンの効能がリスクを上回っている」と規制当局が判断した場合に限り付与されます。
安全性、有効性、品質が常にバランスの取れた状態であること
現状、新型コロナウイルス ワクチンの臨床パイプラインでは数百の治験施設で 4 万人に達する参加者による大規模なフェーズ 3 試験が計画され、画期的な速さで臨床試験が開始されています。ファイザーのワクチン候補 (BNT162b2) に対するフェーズ 2/フェーズ 3 の安全性・有効性試験は、フェーズ 1/フェーズ 2 の安全性・免疫原性試験終了からわずか 3 か月後に開始されました。また FDA 認可からわずか 2 時間後、ファイザーは第 1 回治験参加者に最初のワクチンを投与しています。
ロシアでは 11 月 23 日時点で、2 種類のワクチンが承認されています。ただしロシアの場合、両ワクチンともフェーズ 3 の開始前に連邦保健省が認可しています。ロシアのウラジーミル・プーチン大統領が 8 月に行った声明はワクチンの専門家らの間で大きな懸念とともに受け止められ、規制承認の拙速ぶりは「愚かでは片付けられない」とし、また「極めて恐ろしく、リスキーこの上ない」との批判も挙がっています。
薬剤開発は安全性、有効性、品質が常に一定のバランスを保つ環境で行われ、ワクチン開発競争はスピードと信頼できる完全なデータが両立することで初めて成り立つものです。
競争から協働へ: 開発期間短縮への挑戦
今回の感染拡大期、最先端治療法の一刻も早い上市を巡って競争を繰り広げてきた業界のリーダーたちですが、現在は異例の協力関係を結んでいます。通常は製薬各社内で門外不出とされている独自の技術や高度な技能が現在、新型コロナウイルス ワクチンを一刻も早く世に送り出すために共有されています。
こうしたパートナーシップの代表例が、世界最大級のワクチン メーカーであり、長年にわたってライバル関係にある GSK とサノフィの協働です。GSK のアジュバント技術とサノフィ製造のワクチン候補を組み合わせることで、ワクチン候補の免疫応答性が向上し、1 回あたりの必要量を削減できます。感染拡大の勢いが増す中、米国政府に 1 億回分のワクチンを共同で供給する責任を担う両社にとって、今回の効能拡大は極めて重要な役割を果たすでしょう。
各社連携の構え: 臨床試験の同時実施
これほどのスピードで開発が進むのは記録的です。
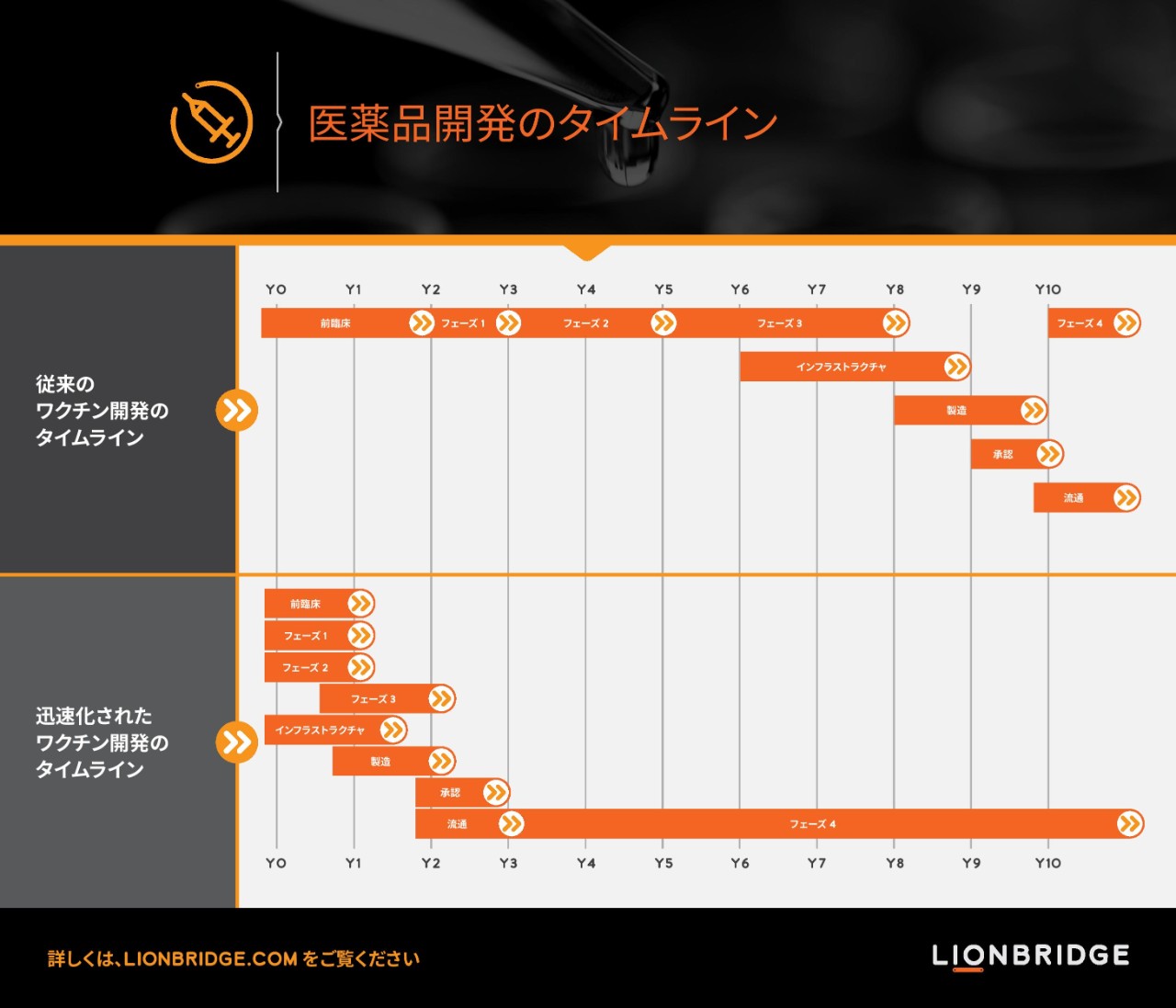
ワクチン開発は創薬から規制当局のライセンス業務、複数のフェーズにわたって行われる臨床開発プログラムを経るため、通常 10 年以上の年月を要します。現在行われている新型コロナウイルス ワクチン開発では、複数のプロセスを同時進行することで開発を迅速化しています。フェーズ 1/フェーズ 2、フェーズ 2/フェーズ 3 を連続して実施する臨床試験設計方式の導入により、開発の迅速化が実現しました。臨床試験では複数の母集団を採用し、評価を複数回測定したほか、ワクチン候補の数も増やしました。
一例を挙げると、ファイザーはフェーズ 1/フェーズ 2 試験で同時に 4 種類のワクチン候補を試験し、フェーズ 2/フェーズ 3 試験でワクチン候補 (BNT162b2) を選定しました。BNT162b2 のフェーズ 2/フェーズ 3 試験は米国、アルゼンチン、ブラジル、ドイツ、南アフリカ、トルコにおける 155 の試験施設で実施され、約 44,000 名が参加しました。本治験は参加者や治験施設の数が多いだけではなく、臨床試験の母集団も多様性が確保されています。本治験は当初 85 歳以下の成人を 3 つの年齢集団に分けて開始しましたが、その後対象年齢を 12 歳以上の未成年者まで広げました。また、本ワクチンについては HIV 感染症、慢性 B 型肝炎、慢性 C 型肝炎の患者を対象にした臨床試験も実施されています。ワクチンの共同開発者であるファイザーと BioNTech は 2020 年に 5,000 万回分、2021 年末には 13 億回分のワクチンを生産するものと見込まれています。
新型コロナウイルスが今後の臨床試験モデルに与える影響
新型コロナウイルスの世界的流行により、前臨床からフェーズ 3 終了まで 8 年を要する通常の臨床試験が 2 年まで短縮できること、またワクチンがわずか 3 年で上市できることが立証されました。開発期間がここまで短縮できるのは記録的なことです。新型コロナウイルス ワクチンが今年末までに接種可能になると見込めるのも、こうした理由によるものです。

業界、規制当局、政府、医療機関にわたる前例のない世界的なこの取り組みは、現在有効な治療法のない、その他の救命治療や希少疾患治療向け臨床試験の期間短縮にも寄与するのでしょうか? 綿密なスケジュール管理が感染拡大期に実現できたなら、こうした状況下にある患者も同様の恩恵を享受できるはずです。新型コロナウイルスのパンデミックによって、薬剤開発と製造が数年で完了するという事実が提示されただけでなく、臨床試験の実施の迅速化に寄与した電子日誌やオンライン診療、スマートフォン、ウェアラブル端末といったデジタル インフラやツールも普及しました。
臨床試験の実施の迅速化はサプライチェーンとサービス プロバイダー全体に影響し、今後は業界や規制当局の要望に応えるため、スピードや対応の迅速化が求められるでしょう。臨床試験や薬剤の市販承認許可プロセスの迅速化は言語サービス プロバイダーのサービス モデルにも影響を及ぼし、納品や人材確保、対応言語の面でより積極的な対応が求められると予測されます。言語資産や自動化処理、さらには綿密な言語品質保証体制によるリスク管理に加えて、柔軟性やスケーラビリティを各種サービスにより取り入れていくことが重要になります。