IDIOMA:
- QUÉ HACEMOS
- IA
Centros de conocimientos de Lionbridge
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad

- SECTORES

Servicios de contenido
- Redacción técnica
- Formación y aprendizaje electrónico
- Informes financieros
- Marketing digital
- SEO y optimización de contenido
Servicios de traducción
- Localización de vídeo
- Localización de software
- Localización de sitios web
- Traducción para empresas reguladas
- Interpretación
- Eventos en directo
Servicios de pruebas
- Pruebas y controles de calidad funcionales
- Pruebas de compatibilidad
- Pruebas de interoperabilidad
- Pruebas de rendimiento
- Pruebas de accesibilidad
- Prueba UX/CX
Soluciones
- Modelos de servicio de traducción
- Traducción automática
- Smart Onboarding™
- Aurora AI Studio™
Nuestros Centros de conocimientos
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad
- Centro de recursos lingüísticos para la COVID-19
- Serie Tiempos de cambio
- Compromiso del paciente
- Monográficos de Lionbridge
Sector biomédico
- Sector farmacéutico
- Aspectos clínicos
- Cuestiones normativas
- Actividades posteriores a la aprobación
- Ámbito corporativo
- Productos sanitarios
- Validación e investigaciones clínicas
- Cuestiones normativas
- Actividades posteriores a la autorización
- Ámbito corporativo
Banca y finanzas
Minorista
Lujo
Comercio electrónico
Lionbridge Games
Automoción
Bienes de consumo envasados
Tecnología
Fabricación industrial
Servicios jurídicos
Viajes / Hostelería
SELECCIONAR IDIOMA:
Nadie que cuente con cierta experiencia en el sector farmacéutico se atrevería a afirmar que el proceso regulador es sencillo.
Descubra cómo reducir la complejidad.
El panorama actual de la investigación clínica es increíblemente vasto y el número de ensayos que se producen en el mundo aumenta cada año. Actualmente se están realizando 284 522 estudios en 204 países en todo el mundo. Este contexto suscita entusiasmo, ya que supone más innovación que da lugar a más soluciones para más enfermedades en más poblaciones, pero también aporta mayor complejidad a un mercado ya de por sí complicado.
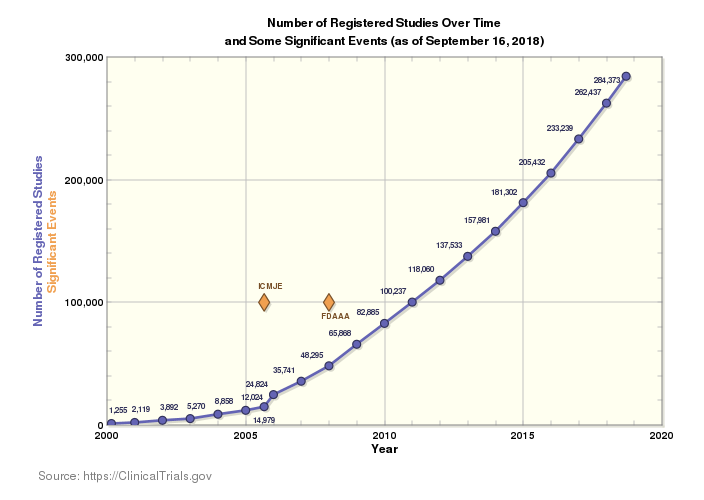
Mas ensayos en más países y más idiomas significa más normas que deben aplicarse, más personas que deben tenerse en cuenta y más regulaciones que deben seguirse en las cadenas de suministro clínico. Esto, sumado a la omnipresente presión por acortar los tiempos de comercialización, reducir costes y eliminar errores en el suministro y la entrega, hace que garantizar el cumplimiento sea más complicado que nunca.
Pero ¿cumplir la normativa tiene que ser sinónimo, necesariamente, de complicaciones? No. Aquí le presentamos tres formas de reducir la complejidad del proceso de etiquetado clínico que emplean las empresas inteligentes.
1. Cree una base de datos certificada de traducciones y contenido normativo.
El proceso para preparar las etiquetas clínicas de forma que se garantice tanto la precisión como el cumplimiento es en gran medida manual. Muchas personas deben revisar la documentación antes de que salga, numerosos colaboradores externos tienen diferentes opiniones y perspectivas, y partes distintas tienen preferencias diferentes en cuanto a traducciones, lo cual puede llevar a las empresas farmacéuticas a «reinventar la rueda» cada vez que realizan un nuevo proyecto de etiquetado clínico.
Las bases de datos certificadas de traducciones y contenido normativo, con bibliotecas de frases coherentes y completas, reducen los plazos del ciclo, estandarizan el contenido, permiten realizar cambios en fases posteriores más rápido y reducen el riesgo al mantener la coherencia a lo largo de todo el proceso. Resultado: sus productos llegan al mercado antes, a menor coste y con menos riesgo.
2. Confíe en expertos del mercado local, no en sus colegas.
Como las empresas farmacéuticas se esfuerzan por hacer más con menos recursos, a menudo intentan contener los costes recurriendo a «recursos prestados» internos para gestionar las exigencias normativas. Pero apoyarse en sus colegas para lograr el cumplimiento y llevar a cabo el proceso de etiquetado clínico suele traducirse en un aumento tanto de los costes como de la complejidad. ¿Por qué? Ese proceso de traducción y validación normativa «por etiqueta» da lugar a plazos más largos, una mayor prevalencia de errores y una mayor dificultad para comprobar el cumplimiento.
Las organizaciones inteligentes saben que invertir en los expertos locales adecuados, conocedores tanto de la normativa como del idioma, garantiza que el etiquetado se realice siempre de forma precisa y rápida. Y además, al abandonar el sistema «por etiqueta» a favor de un proceso estandarizado en torno a dichos expertos, reducen su perfil de riesgo.
3. Apueste por la creatividad controlada.
A veces es necesaria cierta creatividad para encontrar las mejores soluciones a los problemas que provoca el aumento de la complejidad y un panorama regulador en constante cambio. Por ejemplo, su organización podría reducir al mínimo las rondas de edición y reetiquetado empezando intencionadamente más tarde el proceso de etiquetado, lo cual también ayudaría a gestionar el almacenaje, la logística y la vida útil de los productos. O podría agilizar las traducciones mediante el uso de sólidas bibliotecas de frases y tecnología lingüística innovadora.
Sin embargo, en ese intento de reducir la complejidad, algunas soluciones pueden generar a su vez nuevas complicaciones. Es preciso que todas sean diseñadas, desarrolladas y gestionadas por especialistas. Si desea resolver sus problemas de forma integral, sistemática y creativa, la mejor solución pasa por trabajar con un socio que pueda ocuparse de toda esa logística en su lugar.
En Lionbridge Life Sciences, buscamos constantemente la manera de ayudar a nuestros clientes a superar las dificultades que les impiden sacar al mercado medicamentos seguros, eficaces y asequibles lo más rápidamente posible. Obtenga más información sobre cómo puede superar estas cuestiones y lo que sus colegas hacen para abordar la complejidad cada vez mayor del etiquetado clínico de los medicamentos en investigación (IMP / IND) en este reciente seminario con Peter Quigley, vicepresidente de Lionbridge Life Sciences, a través de DIA o póngase en contacto con nosotros.
#contenido regulado #empresas farmacéuticas #ensayos clínicos #etiquetado de ensayos clínicos #investigación clínica #sector biomédico

